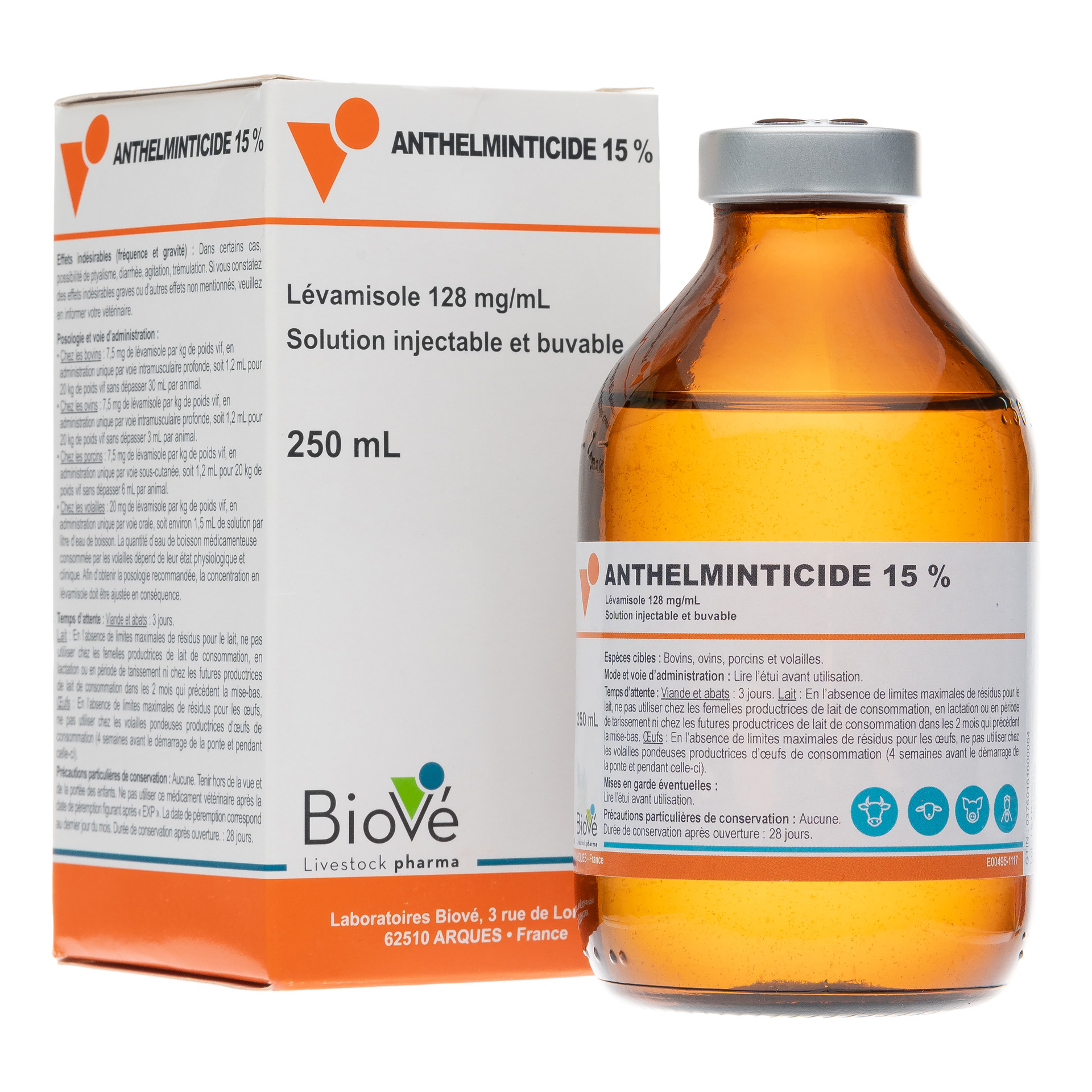
ANTHELMINTICIDE® 15 %
Laboratoires Biové S.A.S., membre d’InovetSolution injectable et buvable
Composition
Principes actifs et excipients
Principes actifs
| Nom du principe actif | Quantité de principe actif |
|---|---|
| Lévamisole (sous forme de chlorhydrate) | 128 mg/mL |
Informations complémentaires
équivalant à 150,9 mg de chlorhydrate de lévamisole.
Clinique
Indications d'utilisation par espèce
- Bovins
- Ovins
Traitement des infestations par les parasites suivants :
-Nématodes gastro-intestinaux :
Trichostrongylus spp,
Cooperia spp,
Ostertagia ostertagi (sauf larves inhibées),
Haemonchus spp,
Nematodirus spp,
Bunostomum spp,
Oesophagostomum spp,
Chabertia ovina (mouton).
- Strongles pulmonaires :
Dictyocaulus viviparus.
- Porcins
Traitement des infestations par les parasites suivants :
- Nématodes gastro-intestinaux :
Ascaris suum,
Strongyloïdes ransomi,
Oesophagostomum spp.
- Strongles pulmonaires :
Metastrongylus spp.
- Volaille
Traitement des infestations par les parasites suivants :
Ascaridia spp,
Hétérakis spp,
Capillaria spp,
Amidostomum anseris (oie).
Voie d'administration et posologie
Voie d'administration
- Sous-cutanée
- Intramusculaire
- Orale
Posologie
- Ovins
7,5 mg de lévamisole par kg de poids vif, en administration unique par voie intramusculaire profonde, soit 1,2 mL pour 20 kg de poids vif sans dépasser 3 mL par animal.
Un sous-dosage pourrait entraîner une utilisation inefficace et favoriser le développement de résistances.
Pour assurer un dosage correct, le poids vif doit être déterminé aussi précisément que possible.
Si les animaux doivent être traités collectivement, il convient de constituer des groupes raisonnablement homogènes et de doser tous les animaux d’un groupe à la dose correspondant à celui qui est le plus lourd.
Le bouchon des flacons ne peut pas être ponctionné plus de 20 fois.
Pour les flacons multidoses, il est recommandé d’utiliser une seringue automatique afin de limiter le nombre de percements du bouchon. Vérifier soigneusement la précision de la seringue.
- Porcins
7,5 mg de lévamisole par kg de poids vif, en administration unique par voie sous-cutanée, soit 1,2 mL pour 20 kg de poids vif sans dépasser 6 mL par animal.
Un sous-dosage pourrait entraîner une utilisation inefficace et favoriser le développement de résistances.
Pour assurer un dosage correct, le poids vif doit être déterminé aussi précisément que possible.
Si les animaux doivent être traités collectivement, il convient de constituer des groupes raisonnablement homogènes et de doser tous les animaux d’un groupe à la dose correspondant à celui qui est le plus lourd.
Le bouchon des flacons ne peut pas être ponctionné plus de 20 fois.
Pour les flacons multidoses, il est recommandé d’utiliser une seringue automatique afin de limiter le nombre de percements du bouchon. Vérifier soigneusement la précision de la seringue.
- Bovins
7,5 mg de lévamisole par kg de poids vif, en administration unique par voie intramusculaire profonde, soit 1,2 mL pour 20 kg de poids vif sans dépasser 30 mL par animal.
Un sous-dosage pourrait entraîner une utilisation inefficace et favoriser le développement de résistances.
Pour assurer un dosage correct, le poids vif doit être déterminé aussi précisément que possible.
Si les animaux doivent être traités collectivement, il convient de constituer des groupes raisonnablement homogènes et de doser tous les animaux d’un groupe à la dose correspondant à celui qui est le plus lourd.
Le bouchon des flacons ne peut pas être ponctionné plus de 20 fois.
Pour les flacons multidoses, il est recommandé d’utiliser une seringue automatique afin de limiter le nombre de percements du bouchon. Vérifier soigneusement la précision de la seringue.
- Volaille
20 mg de lévamisole par kg de poids vif, en administration unique par voie orale, soit environ 1,5 mL de solution par litre d'eau de boisson.
La prise d’eau médicamenteuse dépend de l’état clinique des animaux. Afin d’obtenir la posologie appropriée, il peut être nécessaire d’ajuster en conséquence la concentration de lévamisole.Un sous-dosage pourrait entraîner une utilisation inefficace et favoriser le développement de résistances.
Pour assurer un dosage correct, le poids vif doit être déterminé aussi précisément que possible.
Si les animaux doivent être traités collectivement, il convient de constituer des groupes raisonnablement homogènes et de doser tous les animaux d’un groupe à la dose correspondant à celui qui est le plus lourd.
Le bouchon des flacons ne peut pas être ponctionné plus de 20 fois.
Pour les flacons multidoses, il est recommandé d’utiliser une seringue automatique afin de limiter le nombre de percements du bouchon. Vérifier soigneusement la précision de la seringue.
Temps d'attente
- Porcins
- Bovins
- Ovins
- Volaille
Denrée Durée Unité Voie(s) d'administration Viande et abats3 Jour Sous-cutanéeIntramusculaireOrale
Complément d'information temps d'attente
Lait : en l’absence de limites maximales de résidus pour le lait, ne pas utiliser chez les femelles productrices de lait de consommation, en lactation ou en période de tarissement ni chez les futures productrices de lait de consommation dans les 2 mois qui précédent la mise-bas.
Œufs : en l’absence de limites maximale de résidus pour les œufs, ne pas utiliser chez les volailles pondeuses productrices d’œufs de consommation (4 semaines avant le démarrage de la ponte et pendant celle-ci).
Contre indications
Ne pas utiliser en cas d’hypersensibilité à la substance active ou à l’un des excipients.
Mises en garde particulières à chaque espèce cible
Une utilisation non justifiée d’antiparasitaires ou une utilisation non conforme aux instructions du RCP peuvent augmenter la pression de sélection de résistance et conduire à une diminution de l’efficacité. La décision d’utiliser le médicament vétérinaire doit être fondée sur la confirmation de la présence de l’espèce de parasite et sur la charge parasitaire, ou sur le risque d’infestation évalué à partir des données épidémiologiques pour chaque groupe d’animaux ou chaque animal de destination.
Une utilisation répétée pendant une durée prolongée, en particulier lorsque la même classe de substances est utilisée, augmente le risque de développement de résistance. Au sein d’un élevage ou d’une bande, la préservation de populations « refuges » de parasites sensibles est essentielle pour réduire ce risque.
Les traitements systématiques à intervalle déterminé et le traitement de l’ensemble du troupeau doivent être évités.
Au lieu de cela, si possible, seuls des individus ou des sous-groupes sélectionnés doivent être traités (traitement ciblé sélectif). Cela doit être associé à des mesures appropriées de gestion de l’élevage et de conduite de pâtures.
Demander au vétérinaire responsable des conseils spécifiques pour chaque troupeau ou bande.
Des cas de résistance au lévamisole ont été signalés parmi les espèces de nématodes, en particulier chez Cooperia spp. et Ostertagia spp. chez les bovins, Haemonchus contortus, Teladorsagia spp. et Trichostrongylus spp. chez les ovins et Oesophagostomum spp. chez les porcins.
Des souches d’H. contortus multirésistantes aux benzimidazoles, ivermectine et lévamisole ont été identifiées.
L’utilisation de ce médicament vétérinaire doit tenir compte des informations locales sur la sensibilité des parasites cibles, lorsqu’elles sont disponibles.
Il est recommandé d’examiner plus avant les cas de résistance suspectée, en utilisant une méthode de diagnostic appropriée (par exemple, le test de réduction du nombre d’œufs fécaux ou FECRT pour Faecal Egg Count Reduction Test en anglais).
Une résistance confirmée doit être signalée au titulaire de l’autorisation de mise sur le marché ou à l’autorité compétente.
Précautions particulières d'emploi
Précautions particulières pour une utilisation sûre chez les espèces cibles
Sans objet.
Précautions particulières à prendre par la personne qui administre le médicament
Eviter tout contact direct avec la peau.
Bien se laver les mains après utilisation.
Précautions particulières concernant la protection de l'environnement
Sans objet.
Autres précautions
Aucune.
Interactions médicamenteuses et autres formes d'interaction
L'association du médicament vétérinaire avec un agent anticholinestérasique, tels que les antiparasitaires externes organophosphorés doit être évitée.
Utilisation en cas de gravidité de lactation ou de ponte
Les études de laboratoire sur les souris, rats et lapins n’ont pas mis en évidence d’effets tératogènes.
Aucun effet tératogène ou embryotoxique n'a été rapporté chez les bovins, les ovins et les porcins.
Gestation et lactation :
Peut être utilisé au cours de la gestation et lors de l’allaitement.
Effets indésirables
Bovins, ovins, porcins et volailles :
Fréquence indéterminée (ne peut être estimée à partir des données disponibles) : | Agitation; Ptyalisme, Diarrhée; Tremblement. |
Il est important de notifier les effets indésirables. La notification permet un suivi continu de l’innocuité d’un médicament vétérinaire. Les notifications doivent être envoyées, de préférence par l’intermédiaire d’un vétérinaire, soit au titulaire de l’autorisation de mise sur le marché, ou à son représentant local, soit à l’autorité nationale compétente par l’intermédiaire du système national de notification. Voir la rubrique « Coordonnées » de la notice.
Surdosage (symptômes, conduite d’urgences, antidotes)
En cas de surdosage, les signes observés sont ceux résultant d’une stimulation du système nerveux parasympathique : hypersalivation, vomissements, diarrhée, polypnée et ataxie, tremblements, convulsions.
Les antidotes de choix sont l’atropine ou le glycopyrrolate.
Antimicrobiens et antiparasitaires : lutte contre les résistances
Sans objet.
Informations pharmacologiques ou immunologiques
codes ATC
QP52AE01 : lévamisole
Pharmacodynamie
Le lévamisole est un nématodicide de la famille des imidazothiazoles. Il correspond à la forme lévogyre du tétramisole. Du fait de son mode d'action cholinomimétique par fixation sur les récepteurs de l'acétylcholine, il agit au niveau des ganglions nerveux du nématode entraînant ainsi une paralysie à l'origine de la mort du parasite. Le lévamisole n'a pas d'activité ovicide.
Les mécanismes de résistance au lévamisole ont été étudiés sur plusieurs isolats d’H. contortus résistants au lévamisole. Différents types de polymorphismes qui impactent la fonctionnalité de la cible pharmacologique du lévamisole ont été identifiés. Ces résultats indiquent la nature polygénique de la résistance chez ce parasite et confirme l’intérêt particulier de la détection de la mutation S168T (dans la sous unité ACR-8 du récepteur au lévamisole) en tant que marqueur moléculaire pour le diagnostic de la résistance.
Pharmacocinétique et environnement
Après administration orale, la résorption digestive du lévamisole est rapide, le pic de concentration plasmatique est atteint en 2 à 4 heures.
Après administration parentérale, le lévamisole est rapidement absorbé, le pic de concentration plasmatique est atteint en 1 à 2 heures.
Il subit une métabolisation importante au niveau hépatique et est éliminé rapidement et majoritairement par voie urinaire sous forme de métabolites.
Données pharmaceutiques
Incompatibilités majeures
Non connues.
Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 2 ans.
Durée de conservation après ouverture
Durée de conservation après première ouverture du conditionnement primaire : 28 jours.
Température de conservation
À conserver en dessous de 25 °C.
Précautions particulières à prendre lors de l'élimination de médicaments non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Utiliser les dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné.
Nature et composition du conditionnement primaire
Flacon verre type II fermé par un bouchon en chlorobutyle
Titulaire de l'autorisation de mise sur le marché
LABORATOIRE BIARD
3 RUE DE LORRAINE 62510 ARQUES France
Présentations commercialisées et AMM
| Présentation | GTIN | Numéro d'autorisation de mise sur le marché | Date de première mise sur le marché (ou AMM) | Classement du médicament en matière de délivrance | Accessible aux groupements |
|---|---|---|---|---|---|
| Flacon verre de 250 mL | 03760161600064 | FR/V/5623753 1/1986 | 3/17/1986 | Soumis à prescription | Oui |
Responsable de la mise sur le marché
Responsable de la Pharmacovigilance
Compléments d'informations
Date de mise à jour du RCP
5/31/2024Gamme thérapeutique
Gamme thérapeutique
Antiparasitaire internePathogènes (genre)
- Strongles pulmonaires
- Nématodes gastro-intestinaux