
BIMACOX 2,5 MG/ML SUSPENSION BUVABLE POUR AGNEAUX ET VEAUX
BIMEDA FranceSuspension buvable
Composition
Principes actifs et excipients
Principes actifs
| Nom du principe actif | Quantité de principe actif |
|---|---|
| Diclazuril | 2.5 mg/mL |
Informations complémentaires
| Composition qualitative en excipients et autres composants | Composition quantitative si cette information est essentielle à une bonne administration du médicament vétérinaire |
| Parahydroxybenzoate de méthyle (E218) | 1,8 mg |
| Parahydroxybenzoate de propyle | 0,2 mg |
| Cellulose microcristalline et carmellose sodique | / |
| Acide citrique monohydraté | / |
| Polysorbate 20 | / |
| Hydroxyde de sodium (pour l’ajustement du pH) | / |
| Eau purifiée | / |
Suspension homogène de couleur blanche à blanc cassé.
Clinique
Indications d'utilisation par espèce
- Veau
Prévention des signes cliniques des coccidioses dues à Eimeria bovis et Eimeria zuernii.
- Agneau
Prévention des signes cliniques des coccidioses dues à Eimeria crandallis et Eimeria ovinoidalis.
Voie d'administration et posologie
Voie d'administration
- Orale
Posologie
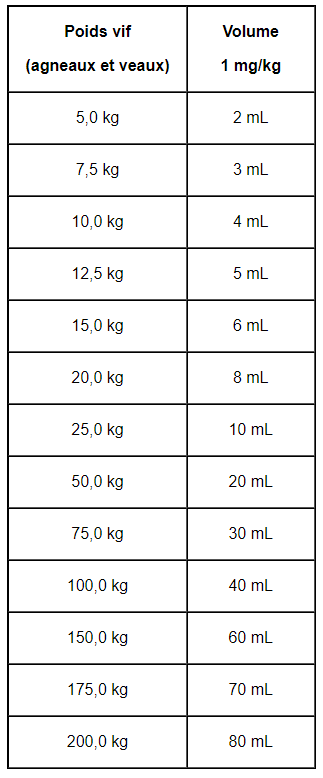
- Veau
- Agneau
Voie orale.
Bien agiter avant utilisation.
L’utilisation d’un équipement de mesure convenablement étalonné est recommandée pour garantir une posologie précise. Ceci est particulièrement important lors de l’administration de petits volumes.
Afin de garantir une posologie appropriée, le poids doit être déterminé aussi précisément que possible.
Si les animaux doivent être traités collectivement plutôt qu’individuellement, il convient de les regrouper par poids vif et d’administrer la dose correspondante afin d’éviter les sous- ou les surdosages.
1 mg de diclazuril par kg de poids vif (soit 1 mL de médicament vétérinaire pour 2,5 kg), en une administration orale unique.
Administrer la suspension buvable directement dans la bouche à l’aide d’un dispositif d’administration adapté.
Temps d'attente
- Ovins
Denrée Durée Unité Voie(s) d'administration Viande et abats0 Jour Orale- Bovins
Denrée Durée Unité Voie(s) d'administration Viande et abats0 Jour Orale
Complément d'information temps d'attente
Lait : Ne pas utiliser chez les animaux producteurs de lait destiné à la consommation humaine.
Contre indications
Ne pas utiliser en cas d’hypersensibilité à la substance active ou à l’un des excipients.
Mises en garde particulières à chaque espèce cible
En l’absence d’antécédents récents et confirmés de coccidiose clinique, il convient de vérifier la présence d’infection coccidienne dans le troupeau avant le traitement.
L’épidémiologie connue d’Eimeria spp. détermine le moment idéal pour le traitement, celui-ci étant le plus efficace pendant la période prépatente de l’infection, avant l’apparition des signes cliniques.
Veaux: Dans certains cas, seule une réduction temporaire de l’excrétion des oocystes peut être obtenue.
Les cas cliniques suspects de résistance aux anticoccidiens doivent faire l'objet d'analyses complémentaires en effectuant les tests appropriés (par exemple le test de réduction de l'excrétion des œufs dans les fèces). En cas de forte suspicion de résistance à un antiprotozoaire particulier suite aux tests, un anticoccidien appartenant à une autre classe pharmacologique et présentant un autre mécanisme d'action devrait être utilisé.
La résistance croisée entre le toltrazuril et le diclazuril est possible et doit être étudiée. Si un test de sensibilité révèle une résistance aux dérivés de la triazine, il convient d’envisager sérieusement de ne pas recourir au diclazuril, car son efficacité peut être réduite.
Précautions particulières d'emploi
Précautions particulières pour une utilisation sûre chez les espèces cibles
L’utilisation du médicament vétérinaire doit être basée sur l’identification et les tests de sensibilité du(des) pathogène(s) cible(s). Si cela n’est pas possible, le traitement doit être basé sur des informations épidémiologiques et sur la connaissance de la sensibilité des agents pathogènes cibles au sein de l’exploitation ou au niveau local/régional.
L’utilisation du médicament vétérinaire doit être conforme aux politiques officielles, nationales et régionales concernant les antimicrobiens.
La coccidiose témoigne d’une hygiène insuffisante au sein d’un troupeau ou d’un enclos. Il est recommandé d’améliorer l’hygiène et de traiter tous les agneaux ou veaux faisant partie d’un même troupeau ou enclos afin de réduire les risques d’infection et d’assurer un meilleur contrôle épidémiologique de la coccidiose.
Pour modifier l’évolution d’une coccidiose clinique établie, il est essentiel de mettre en place une fluidothérapie chez les animaux qui présentent déjà des signes de diarrhée.
L’utilisation préventive de ce médicament vétérinaire doit se limiter aux animaux exposés à un risque très élevé d’infection.
L’utilisation fréquente et répétée d’antiprotozoaires peut entraîner une résistance chez le parasite cible.
Précautions particulières à prendre par la personne qui administre le médicament
Se laver les mains après l’administration du médicament.
Précautions particulières concernant la protection de l'environnement
Sans objet.
Autres précautions
Sans objet.
Interactions médicamenteuses et autres formes d'interaction
Aucune connue.
Utilisation en cas de gravidité de lactation ou de ponte
Sans objet.
Effets indésirables
Ovins (agneaux) et bovins (veaux) :
Très rare (< 1 animal / 10 000 animaux traités, y compris les cas isolés): | Troubles de l’appareil digestif (par exemple, diarrhée1,2); Léthargie, décubitus; Agitation; Signes neurologiques (par exemple parésie) |
1 avec présence possible de sang
2 chez certains animaux traités, même si l’excrétion des oocystes est réduite à un niveau très faible.
Il est important de notifier les événements indésirables. La notification permet un suivi continu de l’innocuité d’un médicament vétérinaire. Les notifications doivent être envoyées, de préférence par l’intermédiaire d’un vétérinaire, soit au titulaire de l’autorisation de mise sur le marché ou à son représentant local, soit à l’autorité nationale compétente par l’intermédiaire du système national de notification. Voir la notice pour les coordonnées respectives.
Surdosage (symptômes, conduite d’urgences, antidotes)
Ovins (agneaux) : aucun signe clinique de surdosage n’a été observé après l’administration de 5 fois la dose recommandée.
Bovins (veaux) : aucun signe clinique de surdosage n’a été observé après une administration unique de 5 fois la dose recommandée. Lors d’une administration répétée de 3 à 5 fois la dose recommandée pendant 3 jours consécutifs, un ramollissement et un changement de couleur (brun foncé) des fèces ont pu être observés chez certains veaux. Ces observations étaient temporaires et régressaient sans traitement spécifique.
Antimicrobiens et antiparasitaires : lutte contre les résistances
Ce médicament est un antiparasitaire. Toute utilisation d’antiparasitaire a un impact potentiel sur les résistances des parasites et sur l’environnement.
Utilisez ce médicament selon les recommandations du Résumé des Caractéristiques du Produit (cf. www.ircp.anmv.anses.fr/).
Informations pharmacologiques ou immunologiques
codes ATC
QP51BC03 : diclazuril
Pharmacodynamie
Le diclazuril est un anticoccidien du groupe des acétonitriles de benzène. Il a une action anticoccidienne contre les espèces Eimeria. En fonction de l'espèce de coccidies, le diclazuril a un effet coccidiocide soit sur les stades sexués soit sur les stades asexués du cycle de développement du parasite. Le traitement par diclazuril n’aura qu’un effet limité sur les lésions intestinales entraînées par les coccidies âgées de plus de 16 jours. Le traitement par diclazuril interrompt le cycle de vie des coccidies et l’excrétion des oocystes pendant environ 2 semaines, cela permet à l’animal de traverser la période de diminution de l’immunité maternelle (observée à l’âge d’environ 4 semaines).
Pharmacocinétique et environnement
Après administration de la suspension buvable, l’absorption du diclazuril est faible chez les agneaux. Chez des agneaux âgés de 2 à 3 semaines, une concentration maximale moyenne de 301 ng/mL a été obtenue environ 16 heures après l’administration d’une dose de 1 mg/kg de poids corporel. La demi-vie d’élimination est d’environ 60 heures. L’absorption orale du diclazuril diminue avec l’âge des animaux. Des études in vitro sur des hépatocytes de mouton ont montré que la transformation métabolique du diclazuril est limitée, ce qui a également été observé chez d’autres espèces animales. L’excrétion se fait presque entièrement par voie fécale.
Chez le veau, l’absorption du diclazuril administré en suspension buvable est faible. Chez le jeune veau, une concentration maximale moyenne de 117 ng/mL a été obtenue environ 16 heures après l’administration d’une dose de 1 mg/kg de poids corporel. La demi-vie d’élimination est d’environ 15 heures.
Propriétés environnementales
Il a été démontré que le diclazuril est très persistant dans le sol.
Données pharmaceutiques
Incompatibilités majeures
En l’absence d'études de compatibilité, ce médicament vétérinaire ne doit pas être mélangé avec d’autres médicaments vétérinaires.
Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 3 ans
Durée de conservation après ouverture
Durée de conservation après la première ouverture du conditionnement primaire : 6 mois
Température de conservation
Ne pas conserver au réfrigérateur et ne pas congeler. À conserver à l’abri du gel.
Précautions particulières à prendre lors de l'élimination de médicaments non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Utiliser les dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné.
Nature et composition du conditionnement primaire
Flacons polyéthylène haute densité (1 L, 2,5 L, 5 L) dotés d’un bouchon inviolable en polypropylène et d’un opercule en aluminium.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l'autorisation de mise sur le marché
BIMEDA ANIMAL HEALTH
UNIT 2/3/4 AIRTON CLOSE TALLAGHT DUBLIN 24 DUBLIN Irlande
Présentations commercialisées et AMM
| Présentation | GTIN | Numéro d'autorisation de mise sur le marché | Date de première mise sur le marché (ou AMM) | Classement du médicament en matière de délivrance | Accessible aux groupements |
|---|---|---|---|---|---|
| Flacon de 5 L | 05391510239772 | FR/V/0859546 1/2024 | 7/4/2024 | Soumis à prescription | Non |
| Flacon de 2,5 L | 05391510239765 | FR/V/0859546 1/2024 | 7/4/2024 | Soumis à prescription | Non |
| Flacon de 1 L | 05391510239758 | FR/V/0859546 1/2024 | 7/4/2024 | Soumis à prescription | Non |
Responsable de la mise sur le marché
Responsable de la Pharmacovigilance
Compléments d'informations
Date de mise à jour du RCP
7/4/2024Gamme thérapeutique
Gamme thérapeutique
AntiprotozoairePathogènes (genre)
- Eimeria
