
BRAVECTO® spot-on chiens
MSD Santé Animale (Intervet)Solution pour spot-on
Composition
Principes actifs et excipients
Principes actifs
| Nom du principe actif | Quantité de principe actif |
|---|---|
| Fluralaner | 112.5 mg |
| Fluralaner | 250 mg |
| Fluralaner | 500 mg |
| Fluralaner | 1000 mg |
| Fluralaner | 1400 mg |
Excipients
| Nom de l'excipient |
|---|
| Diméthylacétamide |
| Glycofurol |
| Diéthyltoluamide |
| Acétone |
Informations complémentaires
Substance active :
Chaque mL contient 280 mg de fluralaner.
Chaque applicateur délivre :
| Bravecto solution pour spot-on | Volume (mL) | Fluralaner (mg) |
| pour chiens de très petite taille 2 – 4,5 kg | 0,4 | 112,5 |
| pour chiens de petite taille > 4,5 – 10 kg | 0,89 | 250 |
| pour chiens de taille moyenne > 10 – 20 kg | 1,79 | 500 |
| pour chiens de grande taille > 20 – 40 kg | 3,57 | 1 000 |
| pour chiens de très grande taille > 40 – 56 kg | 5,0 | 1 400 |
Excipients :
| Composition qualitative en excipients et autres composants |
| Diméthylacétamide |
| Glycofurol |
| Diéthyltoluamide |
| Acétone |
Solution pour spot-on limpide, de couleur jaune à incolore.
Clinique
Indications d'utilisation par espèce
- Chien
- Chienne
Traitement des infestations par les tiques et les puces chez les chiens.
Ce médicament vétérinaire est un insecticide et un acaricide systémique qui assure :
- une activité insecticide immédiate et persistante sur les puces (Ctenocephalides felis et Ctenocephalides canis) pendant 12 semaines, et
- une activité acaricide immédiate et persistante sur les tiques (Ixodes ricinus, Rhipicephalus sanguineus et Dermacentor reticulatus) pendant 12 semaines.
Afin d’être exposées à la substance active, les puces et les tiques doivent être présentes sur l’animal et avoir commencé à se nourrir.
Le médicament vétérinaire peut être utilisé dans le cadre d’un plan de traitement de la dermatite allergique par piqûres de puces (DAPP).
Pour le traitement de la démodécie causée par Demodex canis.
Pour le traitement des infestations par la gale sarcoptique (Sarcoptes scabiei var. canis).
Voie d'administration et posologie
Voie d'administration
- Spot-on
- Cutanée
Posologie
- Chien
- Chienne
Utilisation en spot-on.
Le médicament vétérinaire doit être administré en fonction du tableau suivant (correspondant à une dose de 25 – 56 mg de fluralaner/kg de poids corporel) :
Poids du chien (kg)
Concentration et nombre d’applicateurs à administrer
Bravecto 112,5 mg
Bravecto
250 mg
Bravecto
500 mg
Bravecto
1 000 mg
Bravecto
1 400 mg
2 – 4,5
1
> 4,5 – 10
1
> 10 – 20
1
> 20 – 40
1
> 40 – 56
1
Pour les chiens de plus de 56 kg de poids corporel, utiliser l’association de deux applicateurs qui se rapproche le plus du poids corporel.
Un sous-dosage peut entraîner une utilisation inefficace et favoriser le développement d’une résistance.
Méthode d’administration
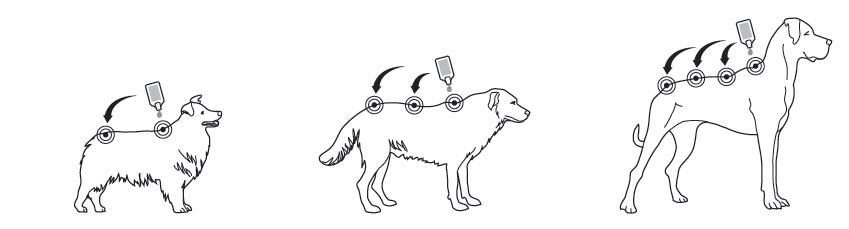
Etape 1 : Ouvrir le sachet et retirer l’applicateur, immédiatement avant utilisation. Mettre des gants. Afin de l’ouvrir, l’applicateur doit être tenu en position verticale (extrémité vers le haut), par la base ou par la partie supérieure rigide sous l’embout. Tourner l’embout complètement dans le sens des aiguilles d’une montre ou dans le sens inverse. L’embout reste sur l’applicateur ; il n’est pas possible de le retirer. L’applicateur est ouvert et prêt pour l’application lorsque le joint est rompu. 
Etape 2 : Le chien doit se tenir debout ou couché, le dos à l’horizontale, pendant l’application. Placer l’embout de l’applicateur en position verticale contre la peau, entre les omoplates du chien.
Etape 3 : Presser l’applicateur doucement et appliquer la totalité de son contenu directement sur la peau du chien en un (lorsque le volume est faible) ou plusieurs points le long de la ligne du dos, à partir de l’épaule jusqu’à la base de la queue. Eviter d’appliquer plus de 1 mL de solution au même endroit, car cela pourrait entraîner l’écoulement d’une partie de la solution ou bien qu’elle s’égoutte hors du chien.
Programme de traitement
En cas d’infestation par les puces et les tiques, la nécessité et la fréquence du ou des retraitement(s) doivent être fondées sur l’avis d’un professionnel et doivent tenir compte de la situation épidémiologique locale et du mode de vie de l’animal.
Pour un contrôle optimal de l’infestation par les tiques et les puces, le médicament vétérinaire doit être administré à intervalles de 12 semaines.
Pour le traitement des infestations par Demodex canis, une seule dose du médicament vétérinaire doit être administrée. Comme la démodécie est une maladie multifactorielle, il est recommandé de traiter également toute maladie sous-jacente de manière appropriée.
Pour le traitement des infestations par la gale sarcoptique (Sarcoptes scabiei var. canis), une seule dose du médicament vétérinaire doit être administrée. La nécessité et la fréquence du retraitement doivent être conformes à l’avis du vétérinaire prescripteur.
Temps d'attente
Complément d'information temps d'attente
Sans objet.
Contre indications
Ne pas utiliser en cas d’hypersensibilité à la substance active ou à l’un des excipients.
Mises en garde particulières à chaque espèce cible
Pour pouvoir être exposés au fluralaner, les parasites doivent avoir commencé à se nourrir sur l’animal ; par conséquent, le risque de transmission de maladies d’origine parasitaire ne peut être exclu.
L'utilisation non nécessaire d'antiparasitaires ou l'utilisation s'écartant des instructions données dans le RCP peut augmenter la pression de sélection de la résistance et conduire à une efficacité réduite. La décision d'utiliser le médicament vétérinaire doit être fondée sur la confirmation de l'espèce parasitaire et de la charge parasitaire, ou du risque d'infestation sur la base de ses caractéristiques épidémiologiques, pour chaque animal.
La possibilité que d'autres animaux du même foyer puissent être une source de réinfection par des parasites doit être envisagée et ces animaux doivent être traités si nécessaire avec un médicament vétérinaire approprié.
Précautions particulières d'emploi
Précautions particulières pour une utilisation sûre chez les espèces cibles
S’assurer que le produit n’entre pas en contact avec les yeux de l’animal.
Ne pas utiliser directement sur les lésions de la peau.
Ne pas laver le chien ou lui permettre de s’immerger dans l’eau, ou de nager dans les cours d’eau, dans les 3 jours suivant le traitement.
En l’absence de données disponibles, ce médicament vétérinaire ne doit pas être utilisé chez les chiots âgés de moins de 8 semaines et/ou chez les chiens dont le poids est inférieur à 2 kg.
Le médicament vétérinaire ne doit pas être administré à moins de 8 semaines d’intervalle, car l’innocuité à des intervalles plus courts n’a pas été testée.
Ce médicament vétérinaire est à usage topique et ne doit pas êtreadministré par voie orale.
Précautions particulières à prendre par la personne qui administre le médicament
Eviter tout contact avec le médicament vétérinaire et porter les gants de protection jetables obtenus avec le médicament vétérinaire sur le point de vente lors de la manipulation du médicament vétérinaire pour les raisons suivantes :
Des réactions d'hypersensibilité ont été signalées chez un petit nombre de personnes, qui peuvent potentiellement être graves.
Les personnes présentant une hypersensibilité connue au fluralaner ou à l'un des excipients doivent éviter tout contact avec le médicament vétérinaire.
Le médicament vétérinaire colle à la peau et peut également coller aux surfaces après le déversement du médicament vétérinaire.
Des éruptions cutanées, des picotements ou des engourdissements ont été signalés chez un faible nombre d’individus après contact avec la peau.
En cas de contact avec la peau, laver immédiatement la zone concernée avec de l’eau et du savon. Dans certains cas, l’eau et le savon ne suffisent pas pour enlever le médicament vétérinaire des doigts.
Le contact avec le médicament vétérinaire peut également se produire lors de la manipulation de l’animal traité.
Assurez-vous que le site d’application de votre animal n’est plus apparent avant un nouveau contact avec le site d’application. Cela inclut câliner l’animal ou partager un lit avec l’animal. Il faut jusqu’à 48 heures pour que le site d’application soit sec, mais il sera visible plus longtemps.
En cas de réactions cutanées, demandez immédiatement conseil à un médecin et montrez-lui la notice ou l’étiquette.
Les personnes ayant une hypersensibilité cutanée ou une allergie connue en général, par exemple à d’autres médicaments vétérinaires de ce type, doivent manipuler le médicament vétérinaire ainsi que les animaux traités avec prudence.
Ce médicament vétérinaire peut causer une irritation des yeux. En cas de contact avec les yeux, rincer immédiatement et abondamment à l’eau.
Ce médicament vétérinaire est nocif après ingestion. Conserver le médicament vétérinaire dans le conditionnement d’origine jusqu’à utilisation, afin d’éviter que les enfants puissent avoir un accès direct au médicament vétérinaire. Tout applicateur usagé doit être jeté immédiatement. En cas d’ingestion accidentelle, demandez immédiatement conseil à un médecin et montrez-lui la notice ou l’étiquette.
Le médicament vétérinaire est hautement inflammable. Conserver à l’écart de toute source de chaleur, source d’étincelles, flamme ou autres sources d’inflammation.
En cas de déversement, par exemple sur la table ou sur le sol, retirer l’excédent du médicament vétérinaire à l’aide d’un mouchoir en papier et nettoyer la surface avec un détergent.
Précautions particulières concernant la protection de l'environnement
Les chiens traités ne doivent pas être autorisés à entrer à la surface de l’eau pendant les 48 heures suivant le traitement afin d’éviter les effets indésirables sur les organismes aquatiques
Autres précautions
Aucune.
Interactions médicamenteuses et autres formes d'interaction
Aucune connue.
Le fluralaner est fortement lié aux protéines plasmatiques. Cela peut entraîner une compétition avec les autres substances actives fortement liées aux protéines plasmatiques comme les anti-inflammatoires non stéroïdiens (AINS) et les dérivés de la coumarine (warfarine). L’incubation de fluralaner avec du carprofène ou de la warfarine dans du plasma de chien aux concentrations maximales attendues dans le plasma n’a pas réduit la liaison du fluralaner, du carprofène ou de la warfarine avec les protéines plasmatiques.
Lors des essais cliniques terrain et en laboratoire, aucune interaction n’a été observée entre le médicament vétérinaire et des médicaments vétérinaires utilisés de façon routinière.
Utilisation en cas de gravidité de lactation ou de ponte
L’innocuité du médicament vétérinaire a été démontrée chez les chiennes reproductrices, gestantes et allaitantes. Peut être utilisé chez les chiennes reproductrices, gestantes et allaitantes.
Effets indésirables
Chiens :
Fréquent (1 à 10 animaux / 100 animaux traités) : | Réactions cutanées au niveau du site d’application (telles que Erythème, Alopécie) # |
Très rare (<1 animal / 10 000 animaux traités, y compris les cas isolés) : | Léthargie, Anorexie Vomissements, Diarrhée ; Prurit ; Tremblements musculaires, Ataxie, Convulsions. |
# légers et transitoires
Il est important de notifier les effets indésirables. La notification permet un suivi continu de l’innocuité d’un médicament vétérinaire. Les notifications doivent être envoyées, de préférence par l’intermédiaire d’un vétérinaire, soit au titulaire de l’autorisation de mise sur le marché, soit à l’autorité nationale compétente par l’intermédiaire du système national de notification. Voir également la rubrique « Coordonnées » de la notice pour les coordonnées respectives.
Surdosage (symptômes, conduite d’urgences, antidotes)
Aucun effet secondaire n’a été observé après administration topique chez des chiots âgés de 8 – 9 semaines et pesant 2,0 – 3,7 kg, traités à des surdosages allant jusqu’ à 5 fois la dose maximale recommandée (56 mg, 168 mg et 280 mg de fluralaner/kg de poids corporel), à trois reprises, à intervalles plus courts que l’intervalle recommandé (intervalles de 8 semaines).
Il n’y a pas eu d’impact sur les performances de reproduction ni sur la viabilité de la progéniture après administration orale du fluralaner à des chiens Beagle, à des surdosages allant jusqu’à 3 fois la dose maximale recommandée (jusqu’à 168 mg de fluralaner/kg de poids corporel).
Le fluralaner a été bien toléré chez les Colleys avec une déficience en multidrug-resistance-protein 1 (MDR1-/-), suite à une administration unique par voie orale à 3 fois la dose maximale recommandée (168 mg/kg de poids corporel). Aucun signe clinique lié au traitement n’a été observé.
Antimicrobiens et antiparasitaires : lutte contre les résistances
Sans objet.
Informations pharmacologiques ou immunologiques
codes ATC
QP53BE02 : Fluralaner
Pharmacodynamie
Le fluralaner est un acaricide et un insecticide. Il est efficace contre les tiques (Ixodes spp., Dermacentor spp. Et Rhipicephalus sanguineus), les puces (Ctenocephalides spp.), les acariens Demodex canis et la gale sarcoptique (Sarcoptes scabiei var. canis) chez le chien.
Le pic d’activité est dans les 8 heures pour les puces (C. felis) et dans les 12 heures pour les tiques (I. ricinus).
Le fluralaner a une activité puissante contre les tiques et les puces en raison de son action via l’alimentation, c’est-à-dire qu’il est actif de façon systémique sur les parasites cibles.
Le fluralaner inhibe de façon puissante certaines parties du système nerveux des arthropodes par une action antagoniste sur les canaux chlorure (récepteur GABA et récepteur Glutamate).
Dans les études moléculaires ciblées sur les récepteurs GABA de la puce et de la mouche, le fluralaner n’est pas affecté par la résistance à la dieldrine.
Dans les bio-dosages in vitro, le fluralaner n’est pas affecté par les résistances terrain prouvées contre les amidines (tique), les organophosphates (tique, acarien), les cyclodiènes (tique, puce, mouche), les lactones macrocycliques (pou du poisson), les phénylpyrazones (tique, puce), les urées benzophényl (tique), les pyréthrinoides (tique, acarien) et les carbamates (acarien).
Le médicament vétérinaire contribue au contrôle des populations de puces se trouvant dans les zones auxquelles les chiens traités ont accès.
Les nouvelles puces infestantes sur un chien sont tuées avant que des œufs viables soient produits. Une étude in vitro a aussi démontré que des concentrations très faibles de fluralaner stoppent la production d’œufs viables par les puces.
Le cycle de vie de la puce est rompu du fait de la mise en place rapide de l’action et de l’effet longue durée contre les puces adultes sur l’animal et l’absence de production d’œufs viables.
Pharmacocinétique et environnement
Le fluralaner est facilement absorbé à partir du site d’administration topique dans les poils, la peau et les tissus sous-jacents, d’où il est lentement absorbé dans le système vasculaire. Un plateau est observé dans le plasma entre 7 et 63 jours après l’administration, puis les concentrations diminuent lentement. La persistance prolongée et la lente élimination du plasma (t½ = 21 jours) et l’absence de métabolisme extensif procurent des concentrations effectives de fluralaner pendant la durée de l’intervalle entre les administrations. Le fluralaner inchangé est excrété dans les fèces et, dans une très faible mesure, dans l’urine.
Données pharmaceutiques
Incompatibilités majeures
Aucune connue.
Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente :
Bravecto 112,5 mg solution pour spot-on : 2 ans.
Bravecto 250 mg / 500 mg / 1 000 mg / 1 400 mg solution pour spot-on : 3 ans.
Précautions particulières de conservation selon pertinence
Ce médicament vétérinaire ne nécessite pas de conditions particulières de conservation en ce qui concerne la température. Les applicateurs doivent être conservés dans l’emballage d’origine, afin de les protéger contre tout risque de fuite de solvant ou d’absorption d’humidité. Les sachets ne doivent être ouverts qu’immédiatement avant utilisation.
Précautions particulières à prendre lors de l'élimination de médicaments non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Le médicament vétérinaire ne doit pas être déversé dans les cours d’eau car le fluralaner pourrait mettre les poissons et autres organismes aquatiques en danger. Utiliser les dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné.
Nature et composition du conditionnement primaire
Applicateur unidose constitué d’une plaquette thermoformée en aluminium laminé/polypropylène scellé par un embout en polyéthylène haute densité, et conditionné en sachet aluminium laminé. Chaque boîte carton contient 1 ou 2 applicateurs et une paire de gants par pipette.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l'autorisation de mise sur le marché
INTERVET INTERNATIONAL B.V.
WIM DE KORVERSTRAAT 35
5831 AN BOXMEER
PAYS-BAS
Présentations commercialisées et AMM
| Présentation | GTIN | Numéro d'autorisation de mise sur le marché | Date de première mise sur le marché (ou AMM) | Classement du médicament en matière de délivrance | Accessible aux groupements |
|---|---|---|---|---|---|
| BRAVECTO® 250 mg Boîte de 2 sachets de 1 applicateur de 0,89 mL | 08713184175199 | BRAVECTO® 112,5 mg : EU/2/13/158/016-017<br />BRAVECTO® 250 mg : EU/2/13/158/020-021<br />BRAVECTO® 500 mg : EU/2/13/158/024-025<br />BRAVECTO® 1 000 mg : EU/2/13/158/028-029<br />BRAVECTO® 1 400 mg : EU/2/13/158/030-031 | 5/17/2016 | Soumis à prescription | Non |
| BRAVECTO® 500 mg Boîte de 2 sachets de 1 applicateur de 1,79 mL | 08713184201423 | BRAVECTO® 112,5 mg : EU/2/13/158/016-017<br />BRAVECTO® 250 mg : EU/2/13/158/020-021<br />BRAVECTO® 500 mg : EU/2/13/158/024-025<br />BRAVECTO® 1 000 mg : EU/2/13/158/028-029<br />BRAVECTO® 1 400 mg : EU/2/13/158/030-031 | 5/17/2016 | Soumis à prescription | Non |
| BRAVECTO® 112,5 mg Boîte de 1 sachet d'1 applicateur de 0,4 mL | 08713184149718 | BRAVECTO® 112,5 mg : EU/2/13/158/016-017<br />BRAVECTO® 250 mg : EU/2/13/158/020-021<br />BRAVECTO® 500 mg : EU/2/13/158/024-025<br />BRAVECTO® 1 000 mg : EU/2/13/158/028-029<br />BRAVECTO® 1 400 mg : EU/2/13/158/030-031 | 5/17/2016 | Soumis à prescription | Non |
| BRAVECTO® 112,5 mg Boîte de 2 sachets d'1 applicateur de 0,4 mL | 08713184175175 | BRAVECTO® 112,5 mg : EU/2/13/158/016-017<br />BRAVECTO® 250 mg : EU/2/13/158/020-021<br />BRAVECTO® 500 mg : EU/2/13/158/024-025<br />BRAVECTO® 1 000 mg : EU/2/13/158/028-029<br />BRAVECTO® 1 400 mg : EU/2/13/158/030-031 | 5/17/2016 | Soumis à prescription | Non |
| BRAVECTO® 1000 mg Boîte de 1 sachet de 1 applicateur de 3,57 mL | 08713184149749 | BRAVECTO® 112,5 mg : EU/2/13/158/016-017<br />BRAVECTO® 250 mg : EU/2/13/158/020-021<br />BRAVECTO® 500 mg : EU/2/13/158/024-025<br />BRAVECTO® 1 000 mg : EU/2/13/158/028-029<br />BRAVECTO® 1 400 mg : EU/2/13/158/030-031 | 5/17/2016 | Soumis à prescription | Non |
| BRAVECTO® 250 mg Boîte de 1 sachet de 1 applicateur de 0,89 mL | 08713184149725 | BRAVECTO® 112,5 mg : EU/2/13/158/016-017<br />BRAVECTO® 250 mg : EU/2/13/158/020-021<br />BRAVECTO® 500 mg : EU/2/13/158/024-025<br />BRAVECTO® 1 000 mg : EU/2/13/158/028-029<br />BRAVECTO® 1 400 mg : EU/2/13/158/030-031 | 5/17/2016 | Soumis à prescription | Non |
| BRAVECTO® 1400 mg Boîte de 1 sachet de 1 applicateur de 5 mL | 08713184149756 | BRAVECTO® 112,5 mg : EU/2/13/158/016-017<br />BRAVECTO® 250 mg : EU/2/13/158/020-021<br />BRAVECTO® 500 mg : EU/2/13/158/024-025<br />BRAVECTO® 1 000 mg : EU/2/13/158/028-029<br />BRAVECTO® 1 400 mg : EU/2/13/158/030-031 | 5/17/2016 | Soumis à prescription | Non |
| BRAVECTO® 1400 mg Boîte de 2 sachets de 1 applicateur de 5 mL | 08713184175212 | BRAVECTO® 112,5 mg : EU/2/13/158/016-017<br />BRAVECTO® 250 mg : EU/2/13/158/020-021<br />BRAVECTO® 500 mg : EU/2/13/158/024-025<br />BRAVECTO® 1 000 mg : EU/2/13/158/028-029<br />BRAVECTO® 1 400 mg : EU/2/13/158/030-031 | 5/17/2016 | Soumis à prescription | Non |
| BRAVECTO® 1000 mg Boîte de 2 sachets de 1 applicateur de 3,57 mL | 08713184175205 | BRAVECTO® 112,5 mg : EU/2/13/158/016-017<br />BRAVECTO® 250 mg : EU/2/13/158/020-021<br />BRAVECTO® 500 mg : EU/2/13/158/024-025<br />BRAVECTO® 1 000 mg : EU/2/13/158/028-029<br />BRAVECTO® 1 400 mg : EU/2/13/158/030-031 | 5/17/2016 | Soumis à prescription | Non |
| BRAVECTO® 500 mg Boîte de 1 sachet de 1 applicateur de 1,79 mL | 08713184149732 | BRAVECTO® 112,5 mg : EU/2/13/158/016-017<br />BRAVECTO® 250 mg : EU/2/13/158/020-021<br />BRAVECTO® 500 mg : EU/2/13/158/024-025<br />BRAVECTO® 1 000 mg : EU/2/13/158/028-029<br />BRAVECTO® 1 400 mg : EU/2/13/158/030-031 | 5/17/2016 | Soumis à prescription | Non |
Responsable de la mise sur le marché
INTERVET
Rue Olivier de Serres
BP 17144
49071 BEAUCOUZE cedex
Responsable de la Pharmacovigilance
INTERVET
Rue Olivier de Serres
BP 17144
49071 BEAUCOUZE cedex
