
CLIKZIN™ 12,5 mg/mL Suspension Pour Pour-On Pour Ovins
ELANCO FRANCESuspension pour pour-on
Composition
Principes actifs et excipients
Principes actifs
| Nom du principe actif | Quantité de principe actif |
|---|---|
| Dicyclanil | 12.5 mg/mL |
Excipients
| Nom de l'excipient | Quantité de l'excipient |
|---|---|
| Jaune de quinoléine (E104) | 0.05 mg/mL |
| Bleu patenté V (E131) | 0.05 mg/mL |
| Parahydroxybenzoate de méthyle (E218) | 1.5 mg/mL |
| Parahydroxybenzoate de propyle (E216) | 3 mg/mL |
| Butylhydroxytoluène (E321) | 0.5 mg/mL |
| Polysorbate 20 | |
| Copolymère d'acide acrylique | |
| Edétate disodique | |
| Monoglycérides distillés | |
| Triglycérides à chaîne moyenne | |
| Propylène glycol | |
| Hydroxyde de sodium | |
| Eau purifiée |
Informations complémentaires
Suspension de couleur verte pour pour-on.
Clinique
Indications d'utilisation par espèce
- Ovins
Prévention des myiases à Lucilia sericata chez les moutons.
Voie d'administration et posologie
Voie d'administration
- Cutanée
Posologie
- Ovins
Pour usage externe exclusivement.
Le médicament vétérinaire s'administre selon le schéma posologique suivant :
Poids vif (kg)
Volume à administrer (mL)
10-20
20
21-30
24
31-50
30
>50
36
(Les volumes indiqués correspondent à une dose de 0,7 à 2 mL de suspension (soit 7,5 à 25 mg de dicyclanil) par kg de poids vif).
Pour une bonne posologie, le poids de l'animal doit être mesuré aussi précisément que possible, afin d'éviter le sous-dosage ; s’assurer de la précision du matériel de dispensation.
Lors de traitements collectifs, rassembler les animaux selon leur poids et régler le dosage en fonction afin d’éviter tout surdosage ou sous-dosage.
Ne pas traiter les ovins ayant une toison de moins de 3 semaines.
Bien agiter le flacon avant utilisation.
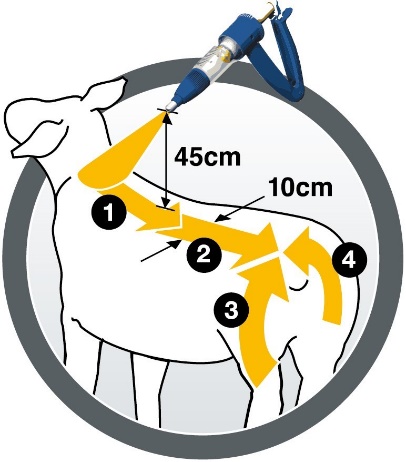
Le médicament vétérinaire doit être appliqué au pistolet, manuel ou automatique, équipé d'une buse de pulvérisation, qui garantit une bonne répartition du produit sur la toison. Les meilleurs résultats sont obtenus en tenant le pistolet à environ 45 cm du mouton. Pulvériser le médicament en utilisant une méthode d’application en quatre étapes, comme indiqué sur le pictogramme, le long de la ligne du dos de l'animal sur une bande d'au moins 10 cm de large du garrot à la croupe (la moitié de la dose) et une bande décrivant un arc de cercle autour de l’arrière-train et de la queue (reste de la dose).
Le médicament vétérinaire doit être administré avant ou au début de la période d'infestation prévue mais peut également être utilisé pendant la saison des mouches.
Une application correcte permet une protection pendant 8 semaines. Selon les bonnes pratiques agricoles, il est recommandé de surveiller régulièrement les animaux.
Temps d'attente
- Ovins
Denrée Durée Unité Voie(s) d'administration Viande et abats7 Jour
Complément d'information temps d'attente
Ne pas utiliser chez les animaux producteurs de lait destiné à la consommation humaine.
Contre indications
Ne pas utiliser en cas d’hypersensibilité connue à la substance active ou à l’un des excipients.
Mises en garde particulières à chaque espèce cible
Aucune.
Précautions particulières d'emploi
Précautions particulières pour une utilisation sûre chez les espèces cibles
Idéalement, le médicament vétérinaire doit être administré avant l'apparition d'un épisode de myiase ou lorsqu'une attaque est identifiée dans l'élevage ou à proximité. Des épisodes avérés de myiase peuvent nécessiter un traitement séparé avec un insecticide à effet rapide.
Il est recommandé de nettoyer la région périnéale des animaux avant application. Si un nettoyage ou une tonte de la région périnéale a lieu dans les semaines qui suivent l'application, ces animaux devront être retraités pour éviter une perte de protection.
Ne pas traiter pendant de fortes pluies ou lorsque de telles conditions sont attendues prochainement car il pourrait en résulter une diminution de la durée de protection.
Précautions particulières à prendre par la personne qui administre le médicament
- Des rougeurs ou une irritation peut se développer à la suite d’un contact du médicament vétérinaire avec la peau ou les yeux.
- Le contact avec la peau et les yeux doit être évité.
- Le port de gants en caoutchouc synthétique et d'un pantalon en PVC est recommandé lors de l'application du médicament vétérinaire.
- En cas de contact avec la peau, retirer les vêtements contaminés et nettoyer soigneusement les parties du corps concernées avec de l'eau et du savon.
- En cas de contact avec les yeux, laver immédiatement à l'eau claire.
- Toujours se laver les mains ainsi que la peau exposée avec l'eau et du savon après manipulation du médicament vétérinaire.
- Ne pas manger, boire ou fumer pendant l'application du médicament vétérinaire.
- Selon les règles de bonnes pratiques agricoles, toute manipulation de l'animal doit être évitée après le traitement. Si l'animal doit être manipulé au cours des 2 mois qui suivent le traitement, porter des gants en caoutchouc synthétique et un pantalon ou une combinaison. Si l'animal est mouillé, porter un pantalon imperméable.
Précautions particulières concernant la protection de l'environnement
Les ovins traités doivent être tenus à l'écart des cours d'eau pendant au moins une heure après le traitement. Si cette recommandation n'est pas suivie, il y a un risque grave pour les poissons et autres organismes aquatiques.
Autres précautions
Aucune.
Interactions médicamenteuses et autres formes d'interaction
Aucune connue.
Utilisation en cas de gravidité de lactation ou de ponte
Gestation et lactation :
L’innocuité du médicament vétérinaire n’a pas été établie en cas de gestation ou de lactation.
L’utilisation ne doit se faire qu’après évaluation du rapport bénéfice/risque par le vétérinaire responsable. Les études en laboratoires chez les rats et les lapins n'ont pas mis en évidence d'effets tératogènes, fœtotoxiques, ou maternotoxiques.
Effets indésirables
Espèce cible : Ovins
Aucun connu.
Il est important de notifier les effets indésirables. La notification permet un suivi continu de l’innocuité d’un médicament vétérinaire. Les notifications doivent être envoyées, de préférence par l’intermédiaire d’un vétérinaire, soit au titulaire de l’autorisation de mise sur le marché ou à son représentant local, soit à l’autorité nationale compétente par l’intermédiaire du système national de notification. Voir la notice pour les coordonnées respectives.
Surdosage (symptômes, conduite d’urgences, antidotes)
Un surdosage supérieur à 20 fois la dose recommandée n’entraîne aucun signe d’intolérance locale ou systémique.
Aucun antidote n’est connu.
Antimicrobiens et antiparasitaires : lutte contre les résistances
Sans objet.
Informations pharmacologiques ou immunologiques
codes ATC
QP53AX24 : dicyclanile
Pharmacodynamie
Le dicyclanil bloque la mue des premier et second stades larvaires de Lucilia spp. Il est moins efficace contre les stades larvaires plus mâtures et n'a pas d'effet sur la forme adulte.
Le mode d'action du dicyclanil est supposé similaire à celui des triazines.
Pharmacocinétique et environnement
Les études montrent qu'environ 5 % d'une dose concentrée à plus de 5 % (p/v) de dicyclanil est absorbée puis éliminée dans l'urine et dans les fèces 7 jours après son administration. Le pic sanguin est atteint entre 12 à 48 heures après administration et représente moins de 0,025 mg d'équivalent dicyclanil par kg.
Lors d'études métaboliques expérimentales, la radioactivité absorbée était largement diffusée dans tout le corps. Les demi-vies les plus longues ont été trouvées dans le foie et les reins et étaient respectivement de 13 et 10 jours.
Le dicyclanil sous forme non métabolisée représente le principal résidu retrouvé dans le muscle, la graisse et la laine. Dans le foie et les reins, les résidus principalement retrouvés sont le descyclopropyl-dicyclanil ainsi que le dicyclanil sous forme non métabolisée.
Dans des études sur la déplétion des résidus, réalisées sur des moutons traités avec le médicament vétérinaire, les taux de résidus à 7 jours sont très faibles (un maximum de 31,9 et 30,7 µg/kg respectivement dans le foie et les reins, et pas de résidus quantifiables dans les muscles ou la graisse), indiquant une absorption systémique minimale.
Propriétés environnementales
L'utilisation de la spécialité est toxique pour les mouches coprophiles, et peut affecter les bousiers.
Données pharmaceutiques
Incompatibilités majeures
En l’absence d’études de compatibilité, ce médicament vétérinaire ne doit pas être mélangé avec d’autres médicaments vétérinaires.
Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 3 ans.
Durée de conservation après ouverture
Durée de conservation après première ouverture du conditionnement primaire : 1 an.
Précautions particulières de conservation selon pertinence
À conserver à l’abri du gel.
À conserver dans l’emballage d’origine.
Conserver l’emballage soigneusement fermé, à distance de toute nourriture, boisson, et des aliments pour animaux.
Protéger des rayons directs du soleil.
Précautions particulières à prendre lors de l'élimination de médicaments non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Le médicament vétérinaire ne doit pas être déversé dans les cours d’eau car la substance active pourrait mettre les poissons et autres organismes aquatiques en danger.
Ne pas contaminer les plans ou cours d'eau avec le produit ou les emballages vides.
Utiliser les dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné.
Nature et composition du conditionnement primaire
L’emballage est composé d’un flacon en polyéthylène haute densité, blanc opaque, avec un bouchon à vis en polypropylène bleu, contenant 0,8, 2,2 ou 5 litres de produit fini.
Titulaire de l'autorisation de mise sur le marché
ELANCO
Heinz-Lohmann-Strasse 4
27472 Cuxhaven
Allemagne
Présentations commercialisées et AMM
| Présentation | GTIN | Numéro d'autorisation de mise sur le marché | Date de première mise sur le marché (ou AMM) | Classement du médicament en matière de délivrance | Accessible aux groupements |
|---|---|---|---|---|---|
| Flacon de 5 litres | 05420036915430 | FR/V/3885778 4/2010 | 7/12/2010 | Soumis à prescription | Oui |
Responsable de la mise sur le marché
ELANCO FRANCE
Crisco Uno, Bâtiment C
3-5 avenue de la Cristallerie
92310 Sèvres - France
Responsable de la Pharmacovigilance
ELANCO FRANCE
Crisco Uno, Bâtiment C
3-5 avenue de la Cristallerie
92310 Sèvres - France
Compléments d'informations
Gamme thérapeutique
Gamme thérapeutique
Antiparasitaire externePathogènes (genre)
- Lucilia
