FENCOVISⓇ Suspension injectable
BOEHRINGER INGELHEIM ANIMAL HEALTH FRANCE SCSSuspension injectable
Composition
Principes actifs et excipients
Principes actifs
| Nom du principe actif | Quantité de principe actif |
|---|---|
| Escherichia coli | 1 PR (puissance relative) |
| Rotavirus bovin | 1 PR (puissance relative) |
| Coronavirus bovin | 1 PR (puissance relative) |
Excipients
| Nom de l'excipient | Quantité de l'excipient |
|---|---|
| Thiomersal | 0.2 mg |
| Formaldéhyde | 1 mg |
| Chlorure de sodium | |
| Chlorure de potassium | |
| Phosphate monopotassique | |
| Phosphate disodique dodécahydraté | |
| Eau pour préparations injectables |
Informations complémentaires
Chaque dose (2 mL) contient :
Substances actives :
Escherichia coli, souche O8 : K35 (adhésine fimbriale F5), inactivé …………………………………………………………………… ≥ 1 PR (*)
Rotavirus bovin, sérotype G6P1, souche TM-91, inactivé ……………………………………………………………………………………………………. ≥ 1 PR (*)
Coronavirus bovin, souche C-197, inactivé ……………………………………………………………………………………………………………………………….. ≥ 1 PR (*)
(*) Puissance relative (PR) déterminée par une méthode ELISA par comparaison avec un sérum de référence obtenu après vaccination de cochons d'Inde avec un lot de vaccin qui a été testé par efficace par épreuve de virulente sur l'espèce cible.
Adjuvants :
Hydroxyde d'aluminium ……………………………………………………………………………………………………………………………………………………………………………….. 6 mg
Saponines de quillaia (Quil A) ………………………………………………………………………………………………………………………………………………………….. ≤ 0,4 mg
Excipient(s) :
Thiomersal ………………………………………………………………………………………………………………………………………………………………………………………………………... 0,2 mg
Formaldéhyde …………………………………………………………………………………………………………………………………………………………………………………………………. ≤ 1 mg
Apparence : liquide, rose à rose intense orangé renfermant un sédiment blanchâtre et qui devient homogène après agitation.
Adjuvants
- Hydroxyde d'aluminium : 6 mg
- Saponines de quillaia (Quil A) : ≤ 0,4 mg
Clinique
Indications d'utilisation par espèce
- Bovins
- Génisse
- Vache
Immunisation active des génisses et des vaches gestantes afin de stimuler le développement d’anticorps contre le rotavirus bovin, le coronavirus bovin et E. coli exprimant l’adhésine F5 (K99) et pour augmenter le niveau d’immunité passive des veaux contre les diarrhées néonatales dues aux rotavirus bovin, coronavirus bovin et E. coli exprimant l’adhésine F5 (K99).
Chez les veaux nourris au colostrum et au lait de vaches vaccinées, durant leur première semaine de vie, des études de laboratoire conduites avec des souches d’épreuve hétérologues (une souche de rotavirus bovin sérotype G6, une souche de coronavirus bovin et une souche E. coli K99) ont démontré que ces anticorps :
- préviennent les diarrhées néonatales causées par le rotavirus bovin et E. coli exprimant l’adhésine F5 (K99),
- réduisent l’incidence et la sévérité des diarrhées néonatales causées par le coronavirus bovin,
- réduisent la dissémination fécale des virus chez les veaux infectés par les rotavirus bovins et coronavirus bovins.
Début de l’immunité :
Chez les veaux nourris au colostrum de génisses ou vaches vaccinées, l’immunité passive débute dès la première prise de colostrum et nécessite que les veaux reçoivent suffisamment de colostrum après la naissance.
Durée de l’immunité :
Les veaux nourris au colostrum et au lait de mères vaccinées durant la première semaine de vie sont protégés contre le rotavirus bovin pour 7 jours et contre le coronavirus bovin pour 14 jours.
La durée de l’immunité contre les infections causées par E. coli exprimant l’adhésine F5 (K99) n’a pas été étudiée car ces maladies sont habituellement observées chez les veaux âgés de moins de 3 jours et la susceptibilité à E. coli entérotoxinogène est âge-dépendante.
Voie d'administration et posologie
Voie d'administration
- Intramusculaire
Posologie
- Bovins
- Génisse
- Vache
Chauffer lentement à température ambiante et agiter doucement le contenu du flacon avant administration.
Administration :
Une dose de 2 mL par voie intramusculaire.
Une injection unique doit être faite durant chaque gestation entre les semaines 12 et 3 avant la date présumée du vêlage.
Ingestion du colostrum :
Les veaux naissent sans anticorps. L’immunité contre les diarrhées des veaux est apportée par l’ingestion rapide des anticorps du colostrum issu de mères vaccinées. La première prise de colostrum doit être effectuée dès que possible, idéalement dans les 2 heures et au maximum 6 heures après la naissance. Chez les veaux de races laitières, elle représente un volume d’environ 10 % du poids corporel, suivi par un volume similaire dans les 12 heures. Les veaux de races à viande doivent rester auprès de leur mère et téter dans les 2 heures après la naissance.
Temps d'attente
- Bovins
- Génisse
- Vache
Denrée Durée Unité Voie(s) d'administration Sans objet 0 Jour Intramusculaire
Complément d'information temps d'attente
Sans objet.
Contre indications
Aucune.
Mises en garde particulières à chaque espèce cible
Vacciner uniquement les animaux en bonne santé.
Précautions particulières d'emploi
Précautions particulières pour une utilisation sûre chez les espèces cibles
Afin d'atteindre des résultats optimaux et de réduire la pression infectieuse dans la ferme, une politique vaccinale de la totalité du troupeau de vaches doit être adoptée, ainsi que des procédures standard de contrôle de maladies infectieuses.
Précautions particulières à prendre par la personne qui administre le médicament
En cas d'effets indésirables après auto-injection accidentelle, demandez immédiatement conseil à un médecin et montrez-lui la notice ou l'étiquette.
Précautions particulières concernant la protection de l'environnement
Sans objet.
Autres précautions
Aucune.
Interactions médicamenteuses et autres formes d'interaction
Aucune information n’est disponible concernant l’innocuité et l’efficacité de ce vaccin lorsqu’il est utilisé avec un autre médicament vétérinaire immunologique. Par conséquent, la décision d’utiliser ce vaccin avant ou après un autre médicament vétérinaire immunologique doit être prise au cas par cas.
Utilisation en cas de gravidité de lactation ou de ponte
Gestation et lactation :
Peut être utilisé au cours de la gestation.
L’effet de la vaccination sur la lactation avant ou après vêlage n’a pas été étudié.
Effets indésirables
Bovins (génisses et vaches gestantes).
| Très fréquent (> 1 animal / 10 animaux traités) : | Température élevée1. |
| Fréquent (1 à 10 animaux / 100 animaux traités) : | Gonflement au point d'injection2. |
1 Augmentation moyenne de 1,0°C pouvant atteindre 2,1°C dans certains cas, se résorbant dans les 2 jours.
2 Localisé (≤ 5 cm de diamètre), léger, se résorbant dans les 2 jours.
Il est important de notifier les effets indésirables. La notification permet un suivi continu de l’innocuité d’un médicament vétérinaire. Les notifications doivent être envoyées, de préférence par l’intermédiaire d’un vétérinaire, soit au titulaire de l’autorisation de mise sur le marché ou à son représentant local, soit à l’autorité nationale compétente par l’intermédiaire du système national de notification. Voir la notice pour les coordonnées respectives.
Surdosage (symptômes, conduite d’urgences, antidotes)
Sans objet.
Antimicrobiens et antiparasitaires : lutte contre les résistances
Sans objet.
Informations pharmacologiques ou immunologiques
codes ATC
QI02AL01 : rotavirus bovin + coronavirus bovin + Escherichia
Pharmacodynamie
Groupe pharmacothérapeutique : médicaments immunologiques pour bovidés, vaccin viral inactivé et bactérien inactivé pour bovins.
La vaccination des génisses et des vaches gestantes induit des anticorps spécifiques qui sont présents à haut niveau de 3 à 12 semaines après vaccination pour l’immunisation passive des veaux via la prise de colostrum contre le rotavirus bovin, le coronavirus bovin et E. coli exprimant l’adhésine F5 (K99).
Données pharmaceutiques
Incompatibilités majeures
Ne pas mélanger avec d’autres médicaments vétérinaires.
Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 2 ans.
Durée de conservation après ouverture
Durée de conservation après première ouverture du conditionnement primaire : 10 heures.
Température de conservation après ouverture
Après ouverture, conserver les flacons à une température ne dépassant pas 25°C.
Température de conservation
À conserver et transporter réfrigéré (entre 2°C et 8°C).
Précautions particulières de conservation selon pertinence
Ne pas congeler.
Protéger de la lumière.
Précautions particulières à prendre lors de l'élimination de médicaments non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Utiliser les dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné.
Nature et composition du conditionnement primaire
Flacons en verre de type I de 3 ou 10 mL avec bouchon en élastomère chlorobutyle et capsule aluminium ou capsule flip-off.
Flacons en verre de type II de 50 ou 100 mL avec bouchon en élastomère chlorobutyle et capsule aluminium ou capsule flip-off.
Flacons en plastique translucide (PEHD) de 15, 60 ou 120 mL avec bouchon en élastomère chlorobutyle et capsule aluminium ou capsule flip-off.
Titulaire de l'autorisation de mise sur le marché
Boehringer Ingelheim Vetmedica GmbH
BINGER STRASSE 173
55216 INGELHEIM AM RHEIN
ALLEMAGNE
Présentations commercialisées et AMM
| Présentation | GTIN | Numéro d'autorisation de mise sur le marché | Date de première mise sur le marché (ou AMM) | Classement du médicament en matière de délivrance | Accessible aux groupements |
|---|---|---|---|---|---|
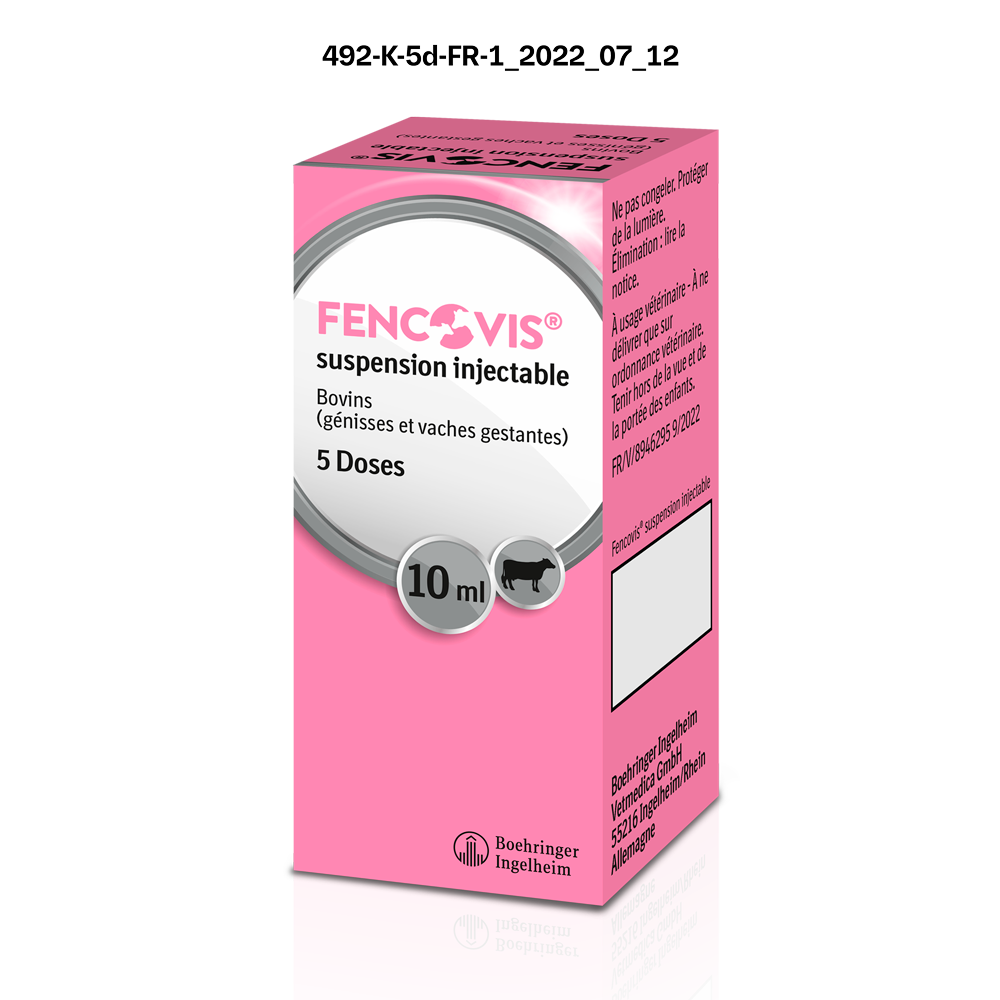
| FENCOVISⓇ Suspension injectable Boîte en carton de 1 flacon en verre de 5 doses (10 mL) | 04064951001529 | FR/V/8946295 9/2022 | 6/27/2022 | Soumis à prescription | Oui |
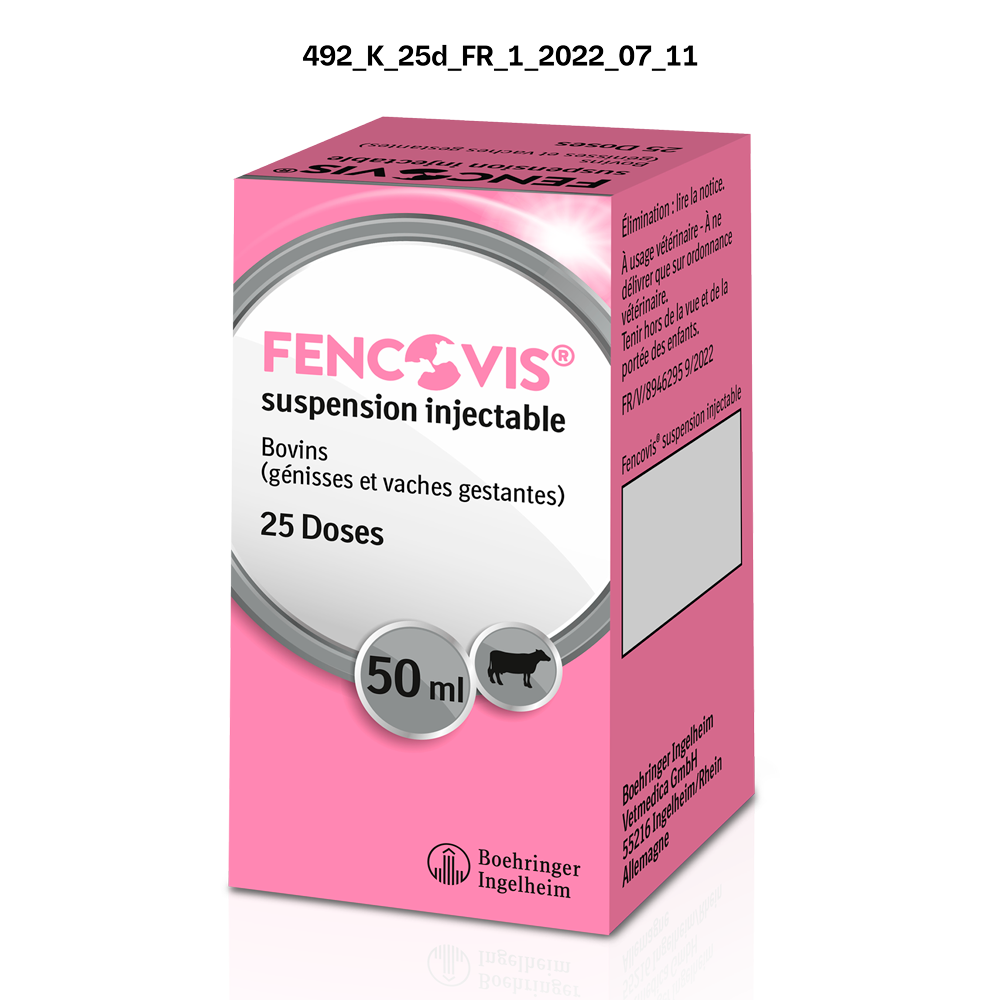
| FENCOVISⓇ Suspension injectable Boîte en carton de 1 flacon plastique de 25 doses (50 mL) | 04064951001536 | FR/V/8946295 9/2022 | 6/27/2022 | Soumis à prescription | Oui |
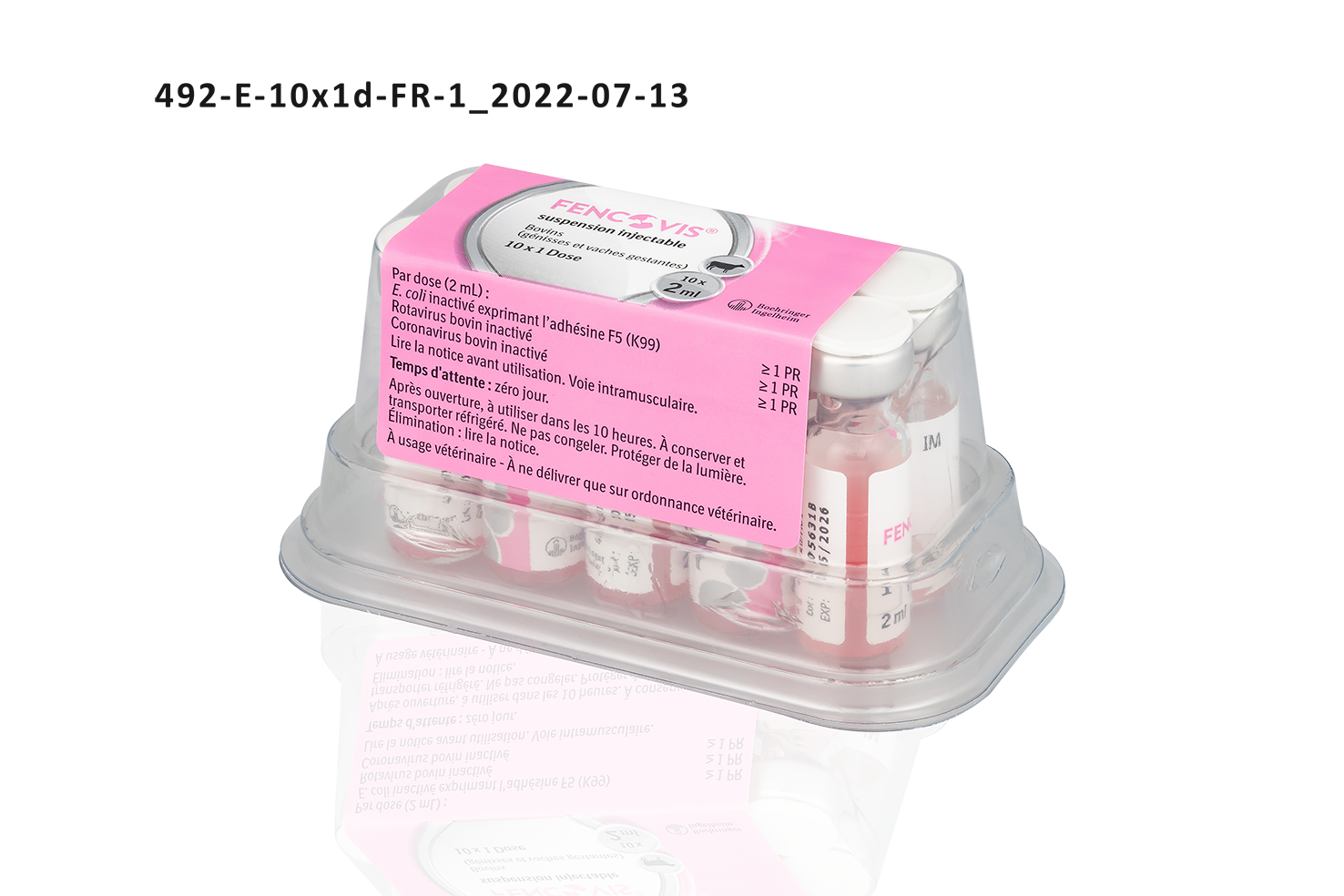
| FENCOVISⓇ Suspension injectable Boîte en plastique de 10 flacons en verre de 1 dose (2 mL) | 04064951001543 | FR/V/8946295 9/2022 | 6/27/2022 | Soumis à prescription | Oui |
Responsable de la mise sur le marché
BOEHRINGER INGELHEIM ANIMAL HEALTH FRANCE SCS
29 avenue Tony Garnier
69007 LYON
FRANCE
Responsable de la Pharmacovigilance
BOEHRINGER INGELHEIM ANIMAL HEALTH FRANCE SCS
29 avenue Tony Garnier
69007 LYON
FRANCE
Compléments d'informations
Date de mise à jour du RCP
12/23/2024Gamme thérapeutique
Gamme thérapeutique
VaccinPathogènes (genre)
- Coronavirus bovin
- Escherichia
- Rotavirus Bovin