Composition
Principes actifs et excipients
Principes actifs
| Nom du principe actif | Quantité de principe actif |
|---|---|
| Flunixine (sous forme de méglumine) | 0.5 g |
Excipients
| Nom de l'excipient | Quantité de l'excipient |
|---|---|
| Propylène glycol | 1 g |
| Carmellose sodique | |
| Amidon de maïs | |
| Eau purifiée |
Informations complémentaires
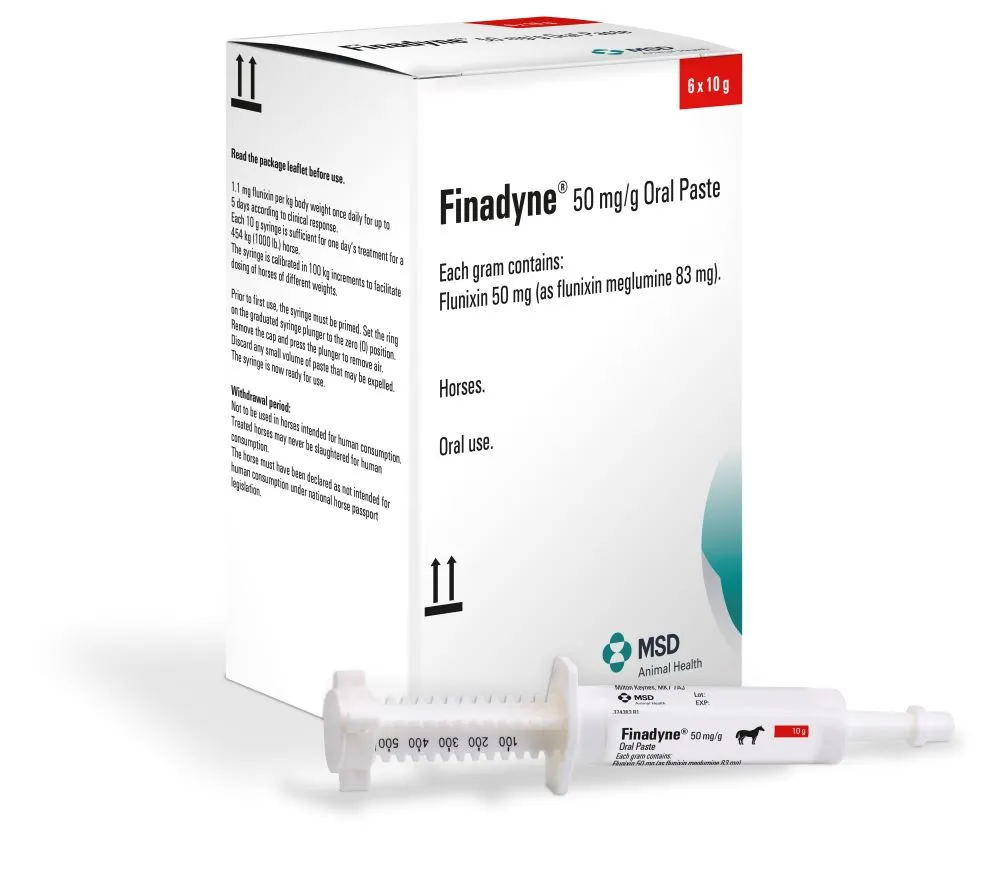
Une seringue de 10 g contient :
Substance active :
Flunixine (sous forme de méglumine) 0,50 g
(équivalant à 0,83 g de flunixine méglumine)
Excipients :
| Composition qualitative en excipients et autres composants | Composition quantitative si cette information est essentielle à une bonne administration du médicament vétérinaire |
Propylène glycol | 1,00 g |
Carmellose sodique | / |
Amidon de maïs | / |
Eau purifiée | / |
Pâte orale blanche à blanc cassé.
Clinique
Indications d'utilisation par espèce
- Equins
Traitement de l’inflammation et soulagement de la douleur des affections musculaires, squelettiques, et de la douleur associée à la colique.
Voie d'administration et posologie
Voie d'administration
- Orale
Posologie
- Equins
Voie orale.
1 mg de flunixine par kg de poids vif et par jour, soit une seringue pour administration orale de 10 g pour 500 kg de poids vif par jour ou le volume correspondant à une graduation du piston par 100 kg de poids vif.
Avant la première administration, la seringue doit être actionnée à perte. Amener le piston de la seringue sur la position zéro de l’échelle de graduation et éliminer le premier jet de pâte en appuyant sur le piston. La seringue est alors prête à l’emploi.
Introduire l’embout de la seringue dans la bouche du cheval et injecter la pâte le plus en arrière possible au-dessus de la langue.
Afin de garantir une posologie appropriée, le poids corporel doit être déterminé aussi précisément que possible.
Temps d'attente
Complément d'information temps d'attente
Viande et abats : 15 jours
Lait : en l’absence de temps d’attente pour le lait, ne pas utiliser chez les femelles productrices de lait de consommation en lactation ou en période de tarissement ni chez les futures productrices de lait de consommation dans les 2 mois qui précèdent la mise-bas.
Contre indications
Ne pas administrer aux animaux atteints d’affections musculo-squelettiques chroniques.
Ne pas administrer aux animaux atteints de maladie hépatique, rénale ou cardiaque.
Ne pas administrer aux animaux présentant des lésions du tractus gastro-intestinal (ulcères gastro-intestinaux ou saignement).
Ne pas utiliser en cas de troubles hémorragiques.
Ne pas utiliser en cas d’hypersensibilité à la flunixine méglumine, à un autre anti-inflammatoire non stéroïdien (AINS) ou à un autre composant du médicament.
Ne pas utiliser chez les animaux atteints de colique causée par un iléus et associée à une déshydratation.
Mises en garde particulières à chaque espèce cible
La cause sous-jacente de l’inflammation ou de la colique doit être déterminée et traitée parallèlement avec une thérapie appropriée.
Précautions particulières d'emploi
Précautions particulières pour une utilisation sûre chez les espèces cibles
Ne pas traiter les chevaux pendant plus de 5 jours consécutifs.
En raison de ses propriétés anti-inflammatoires, la flunixine (sous forme de méglumine) peut masquer les signes cliniques et par conséquent une éventuelle résistance au traitement étiologique antibiotique.
Comme avec d'autres AINS, des effets indésirables rénaux rares ou idiosyncrasiques hépatiques peuvent être observés.
Précautions particulières à prendre par la personne qui administre le médicament
Ne pas manipuler ce médicament vétérinaire si vous présentez une hypersensibilité aux substances appartenant à la famille des AINS. Les réactions d’intolérance peuvent être graves.
En cas de contact avec la peau, rincer immédiatement et abondamment avec de l’eau et du savon. Si les symptômes persistent, demander un avis médical.
En cas de contact avec les yeux, rincer immédiatement et abondamment avec de l’eau et consulter un médecin.
Pour écarter tout risque d’ingestion, il est recommandé de ne pas manger ou boire lors de l’utilisation du médicament vétérinaire et de se laver les mains après utilisation. En cas d'ingestion du médicament vétérinaire, consulter un médecin.
Précautions particulières concernant la protection de l'environnement
La flunixine est toxique pour les oiseaux nécrophages. Ne pas administrer aux animaux susceptibles d’entrer dans la chaîne alimentaire de la faune sauvage. En cas de mort naturelle ou d’euthanasie d’animaux traités, s’assurer que la faune sauvage n’aura pas accès aux carcasses et ne pourra pas les consommer.
Autres précautions
Aucune.
Interactions médicamenteuses et autres formes d'interaction
L'administration simultanée ou dans les 24 heures d'un autre anti-inflammatoire (AINS) doit être évitée car elle peut augmenter la toxicité, en particulier gastro-intestinale, même avec l'acide acétylsalicylique à faibles doses.
L'administration simultanée avec des corticoïdes peut augmenter la toxicité des deux produits et accroître le risque d'ulcération gastro-intestinale. Elle doit donc être évitée.
La flunixine peut diminuer l'effet de quelques médicaments anti-hypertensifs par inhibition de la synthèse de prostaglandines, comme les diurétiques, les IECA (inhibiteurs de l'enzyme de conversion de l'angiotensine) et les ß-bloquants.
Eviter l'administration simultanée de médicaments potentiellement néphrotoxiques, en particulier des aminoglycosides.
La flunixine peut réduire l'élimination rénale de quelques médicaments et augmenter leur toxicité, tels
Utilisation en cas de gravidité de lactation ou de ponte
Les études menées chez les animaux de laboratoire ont révélé une foetotoxicité de la flunixine après administration orale (lapin et rat) et administration intramusculaire (rat) à des doses maternotoxiques ainsi qu'un allongement de la durée de gestation (rat).
L'innocuité de la flunixine n'a pas été établie chez la jument gestante, ni chez l'étalon destiné à la reproduction. Ne pas utiliser la flunixine chez ces animaux.
Effets indésirables
Chevaux :
Très rare (< 1 animal / 10 000 animaux traités, y compris les cas isolés) : | Irritation gastro-intestinale1, Ulcère gastrique1 ; Lésions rénales1 ; Hémorragie1 |
1 Ces réactions sont observées en particulier chez les animaux déshydratés ou en hypovolémie.
Si des effets indésirables apparaissent, interrompre le traitement et demander conseil à un vétérinaire.
Il est important de notifier les effets indésirables. La notification permet un suivi continu de l’innocuité d’un médicament vétérinaire. Les notifications doivent être envoyées, de préférence par l’intermédiaire d’un vétérinaire, soit au titulaire de l’autorisation de mise sur le marché, soit à l’autorité nationale compétente par l’intermédiaire du système national de notification. Voir également la rubrique « Coordonnées » de la notice.
Surdosage (symptômes, conduite d’urgences, antidotes)
La flunixine est un anti-inflammatoire non stéroïdien. Le surdosage est associé à la toxicité gastro-intestinale. Des symptômes d'ataxie et d'incoordination peuvent aussi apparaître.
Antimicrobiens et antiparasitaires : lutte contre les résistances
Sans objet.
Informations pharmacologiques ou immunologiques
codes ATC
QM01AG90 : flunixine
Pharmacodynamie
La flunixine (sous forme méglumine) agit comme inhibiteur réversible non sélectif de la cyclooxygénase (COX), une enzyme qui convertit l'acide arachidonique en endopéroxides cycliques instables, eux-mêmes transformés en prostaglandines, prostacyclines et tromboxanes. Quelques-uns de ces prostanoïdes, comme les prostaglandines, sont impliqués dans les mécanismes physiopathologiques de l'inflammation, de la douleur et de la fièvre. L'inhibition de la synthèse de ces composés serait responsable des effets thérapeutiques de la flunixine méglumine.
Etant donné que les prostaglandines sont aussi impliquées dans d'autres processus physiologiques, l'inhibition de la COX serait aussi responsable de certains effets indésirables comme les lésions gastro-intestinales et rénales.
Les prostaglandines font partie des processus complexes impliqués dans le développement du choc endotoxique.
Pharmacocinétique et environnement
Le temps de demi-vie d'élimination est d'environ 2 heures.
La flunixine est éliminée essentiellement par voie urinaire sous forme conjuguée.
Données pharmaceutiques
Incompatibilités majeures
En l'absence d'études de compatibilité, ce médicament vétérinaire ne doit pas être mélangé avec d'autres médicaments vétérinaires.
Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 3 ans.
Température de conservation
Ce médicament vétérinaire ne nécessite pas de conditions particulières de conservation.
Tenir hors de la vue et de la portée des enfants.
Précautions particulières de conservation selon pertinence
Ce médicament vétérinaire ne nécessite pas de conditions particulières de conservation.
Tenir hors de la vue et de la portée des enfants.
Précautions particulières à prendre lors de l'élimination de médicaments non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Utiliser les dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné.
Nature et composition du conditionnement primaire
Seringue pour administration orale polyéthylène basse densité
Bouchon polyéthylène basse densité
Piston gradué polyéthylène haute densité muni d’une bague polypropylène
Titulaire de l'autorisation de mise sur le marché
Présentations commercialisées et AMM
| Présentation | GTIN | Numéro d'autorisation de mise sur le marché | Date de première mise sur le marché (ou AMM) | Classement du médicament en matière de délivrance | Accessible aux groupements |
|---|---|---|---|---|---|
| FINADYNE® Pâte Boîte de 6 seringues pour administration orale de 10 g | 05017363520378 | FR/V/0954865 5/1991 | 8/1/1991 | Soumis à prescription | Non |
