
FINADYNE TRANSDERMAL® 50 mg/mL
MSD Santé Animale (Intervet)Solution pour Pour-On
Composition
Principes actifs et excipients
Principes actifs
| Nom du principe actif | Quantité de principe actif |
|---|---|
| Flunixine (sous forme de méglumine) | 50 mg |
Excipients
| Nom de l'excipient | Quantité de l'excipient |
|---|---|
| Lévomenthol | 50 mg |
| Rouge allura AC (E129) | 0.2 mg |
| Pyrrolidone | |
| Dicaprylocaprate de propylène glycol | |
| Monocaprylate de glycérol |
Informations complémentaires
Chaque mL contient :
Substance active :
Flunixine ............................................................. 50 mg
(sous forme de méglumine)
(équivalant à 83 mg de flunixine méglumine)
Excipients :
| Composition qualitative en excipients et autres composants | Composition quantitative si cette information est essentielle à une bonne administration du médicament vétérinaire |
Lévomenthol | 50,0 mg |
| |
Rouge allura AC (E129) | 0,2 mg |
| Pyrrolidone | |
Dicaprylocaprate de propylène glycol | |
Monocaprylate de glycérol |
Liquide rouge clair, limpide et exempt de particules visibles.
Clinique
Indications d'utilisation par espèce
- Bovins
- Réduction de la fièvre associée à une maladie respiratoire bovine.
- Réduction de la fièvre associée à des mammites aiguës.
- Réduction de la douleur et de la boiterie associées à un phlegmon interdigité (panaris), une dermatite interdigitée (fourchet) et une dermatite digitée (maladie de Mortellaro).
Voie d'administration et posologie
Voie d'administration
- Pour-on
Posologie
- Bovins
Usage en pour-on. Application unique. La dose de traitement recommandée est de 3,33 mg de flunixine/kg de poids vif (équivalant à 1 mL/15 kg de poids vif). Le système de dosage du flacon est calibré en kilogrammes de poids vif. Afin de garantir une posologie appropriée, le poids corporel doit être déterminé aussi précisément que possible.
Avant de traiter les animaux, tester plusieurs fois les instructions d’administration, afin de se familiariser avec le mode de fonctionnement du système de dosage.
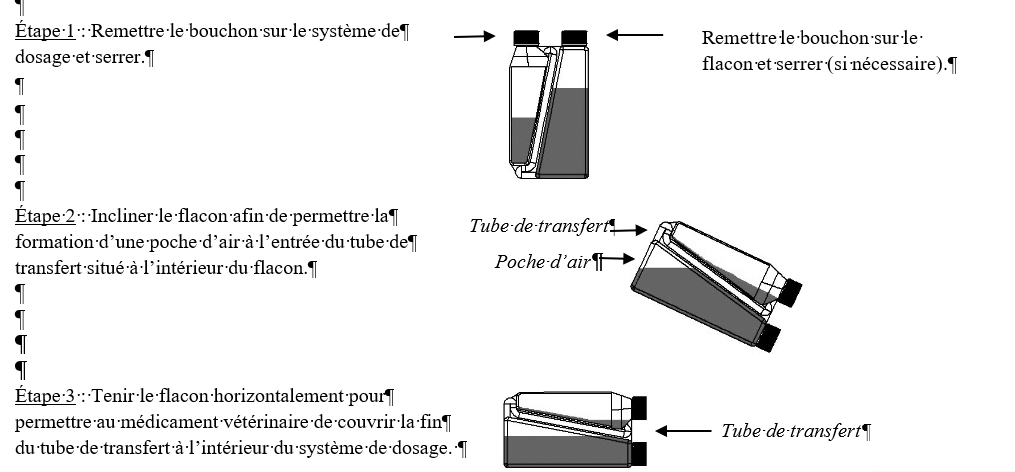
Étape 1 : A la première utilisation, retirer le bouchon et le joint détachable du système de dosage.
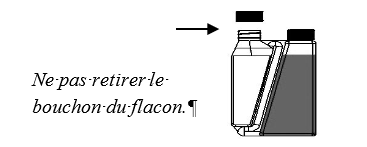
Étape 2 : Tenir le flacon en position verticale au niveau des yeux et
presser lentement et doucement le flacon pour remplir le système de
dosage jusqu’au niveau sélectionné.
Si le système de dosage est trop plein, suivre les Instructions de
Réduction du Trop-plein.
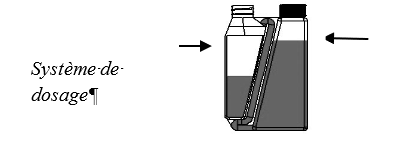
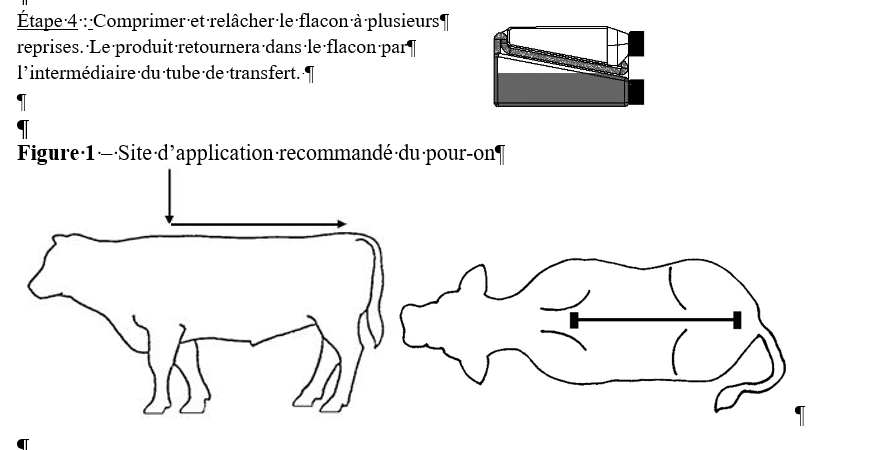
Étape 3 : Verser le volume mesuré le long de la ligne dorsale, à partir du
garrot jusqu’à la base de la queue.
Une petite quantité de liquide reste le long des parois du système de
dosage, mais la calibration de celui-ci en tient compte.
Eviter de comprimer le flacon pendant que la solution est versée à partir
du système de dosage.
Instructions de réduction du trop-plein
Temps d'attente
Complément d'information temps d'attente
Viande et abats : 7 jours.
Lait : 36 heures.
En raison du risque de contamination croisée lors de la toilette (par léchage) des animaux non traités avec ce produit, les animaux traités devraient être mis à l’écart des animaux non traités durant le temps d’attente. Le non-respect de cette recommandation peut entraîner la présence de résidus chez les animaux non traités.
Contre indications
Ne pas administrer aux animaux atteints de maladies cardiaque, hépatique ou rénale, ou s'il existe des signes d'ulcération gastro-intestinale ou de saignement.
Ne pas utiliser chez les animaux atteints de déshydratation sévère, d’hypovolémie car il existe un risque potentiel d’augmentation de toxicité rénale.
Ne pas administrer le médicament vétérinaire aux vaches dans les 48 heures précédant la date prévue de la parturition.
Ne pas utiliser en cas d’hypersensibilité à la substance active ou à l’un des excipients.
Mises en garde particulières à chaque espèce cible
Appliquer uniquement sur une peau sèche et éviter toute exposition à l’humidité pendant au moins 6 heures après l’application.
En cas d’infection(s) bactérienne(s), un traitement antibiotique concomitant devra être envisagé.
Précautions particulières d'emploi
Précautions particulières pour une utilisation sûre chez les espèces cibles
Voir également la rubrique 3.7.
Les anti-inflammatoires non stéroïdiens (AINS) sont connus pour potentiellement retarder la parturition par un effet tocolytique induit par l’inhibition des prostaglandines responsables de l’induction de la parturition. L’utilisation du produit dans la période qui suit la parturition peut interférer avec l’involution utérine et l’expulsion de membranes fœtales, entraînant une rétention placentaire.
Aucune étude d’innocuité n’a été menée chez les taureaux adultes destinés à la reproduction. Les études de laboratoire sur les rats n'ont pas mis en évidence d’effet toxique sur la reproduction. L’utilisation de la spécialité ne doit se faire qu’après évaluation du rapport bénéfice/risque établie par le vétérinaire responsable.
L’utilisation du médicament chez des animaux pré-ruminants et âgés peut entraîner un risque supplémentaire. Si l’utilisation du médicament ne peut pas être évitée, une diminution de la dose et un suivi clinique rigoureux devront être envisagés.
Appliquer uniquement sur une peau saine.
La flunixine est toxique pour les oiseaux nécrophages. Ne pas administrer aux animaux susceptibles d'entrer dans la chaîne alimentaire de la faune sauvage. En cas de mort naturelle ou d’euthanasie d’animaux traités, s’assurer que la faune sauvage n’aura pas accès aux carcasses et ne pourra pas les consommer.
Précautions particulières à prendre par la personne qui administre le médicament
Les anti-inflammatoires non stéroïdiens (AINS) peuvent occasionner une hypersensibilité (allergie).
Les personnes présentant une hypersensibilité connue aux AINS doivent éviter tout contact avec le médicament vétérinaire.
Il a été démontré que le produit peut provoquer des dommages oculaires graves et irréversibles et une légère irritation cutanée. L'ingestion du produit ou tout contact avec la peau peut être nocif.
Eviter tout contact avec les yeux, incluant le contact des yeux par les mains. Eviter tout contact avec la peau.
Eviter tout contact avec la surface traitée (permettant une diffusion du produit) sans le port de gants de protection, pendant au moins trois jours ou jusqu’à ce que le site d’application soit sec (si le délai est plus long).
Eviter que les enfants aient accès au produit ou aux animaux traités.
Un équipement de protection individuelle consistant en des gants imperméables, des vêtements de protection et des lunettes de sécurité doit être porté lors de la manipulation du médicament vétérinaire.
En cas d’ingestion accidentelle ou de contact avec la bouche, rincez immédiatement et abondamment avec de l’eau, demandez immédiatement conseil à un médecin et montrez-lui la notice ou l’étiquette.
En cas de contact avec les yeux, rincez immédiatement et abondamment avec de l’eau propre et demandez conseil à un médecin.
En cas de contact avec la peau, lavez abondamment avec de l’eau et du savon.
Ne pas fumer, manger ou boire lors de la manipulation du produit. Se laver les mains après utilisation.
Précautions particulières concernant la protection de l'environnement
Sans objet
Autres précautions
Aucune.
Interactions médicamenteuses et autres formes d'interaction
Ne pas administrer d’autres AINS simultanément, ou à moins de 24 heures d’intervalle.
Certains AINS peuvent être fortement liés aux protéines plasmatiques et être en concurrence avec d’autres médicaments fortement liés, ce qui peut entraîner des effets toxiques. L’administration simultanée de médicaments potentiellement néphrotoxiques doit être évitée.
Utilisation en cas de gravidité de lactation ou de ponte
Gestation et lactation :
Le produit peut être utilisé pendant la gestation et la lactation, excepté dans les 48 heures qui précèdent la parturition.
En raison du risque accru de rétention placentaire, le produit ne devrait être administré, dans les 36 heures qui suivent la parturition, qu’après évaluation du rapport bénéfice/risque établie par le vétérinaire responsable, et le risque de rétention placentaire devrait être surveillé chez les animaux traités.
Effets indésirables
Bovins :
Fréquent (1 à 10 animaux / 100 animaux traités) : | Gonflement au site d’application1, érythème au site d’application1, peau sèche au site d’application (pellicules)1, changement de l’aspect des poils au site d’application (poils cassés/fragiles, poils plus fins)1, alopécie au site d’application1, épaississement de la peau au site d’application1
Inconfort2 ; Agitation2 ; Irritabilité2 |
Très rare (<1 animal / 10 000 animaux traités, y compris les cas isolés) : | Anaphylaxie3 |
1 Ces changements ont été rapportés comme étant transitoires. En général, aucun traitement spécifique n’est nécessaire.
2 Signes temporaires
3 Peut être grave, peut survenir et doit être traitée de façon symptomatique
Il est important de notifier les effets indésirables. La notification permet un suivi continu de l’innocuité d’un médicament vétérinaire. Les notifications doivent être envoyées, de préférence par l’intermédiaire d’un vétérinaire, soit au titulaire de l’autorisation de mise sur le marché, soit à l’autorité nationale compétente par l’intermédiaire du système national de notification. Voir également la rubrique « Coordonnées » de la notice.
Surdosage (symptômes, conduite d’urgences, antidotes)
Des réactions inflammatoires cutanées localisées et une nécrose de la peau ont été rapportées à la dose de 5 mg/kg.
Des lésions abomasales érosives et ulcératives ont été observées chez les animaux traités avec le médicament vétérinaire à 3 fois la dose recommandée.
Du sang dans les selles a été observé chez certains animaux traités à 5 fois la dose recommandée.
Aucune procédure d’urgence n’est nécessaire.
Antimicrobiens et antiparasitaires : lutte contre les résistances
Sans objet.
Informations pharmacologiques ou immunologiques
codes ATC
QM01AG90 : flunixine
Pharmacodynamie
La substance active, flunixine (sous forme méglumine), est un acide carboxylique anti-inflammatoire non stéroïdien (AINS), possédant une action analgésique et antipyrétique non narcotique. Elle exerce une action inhibitrice puissante sur la cyclooxygénase (COX-1 et COX-2), COX qui convertit l'acide arachidonique en endopéroxides cycliques instables, eux-mêmes transformés en prostaglandines, prostacyclines et tromboxanes. L'inhibition de la synthèse de ces composés est responsable des propriétés analgésique, antipyrétique et antiinflammatoire de la flunixine méglumine.
Dans une étude, Finadyne Transdermal 50 mg/mL solution pour pour-on pour bovins a été expérimentée chez 64 vaches souffrant de mammite, et l’efficacité dans la réduction de la température rectale a été comparée au placebo utilisé chez 66 vaches. Six heures après le traitement, il a été observé une diminution de la température rectale de plus de 1,1°C chez 95,3 % des vaches traitées à l’aide de Finadyne Transdermal 50 mg/mL solution pour pour-on pour bovins, par rapport à 34,9 % dans le groupe placebo. Après 6 heures, lorsque le traitement antibiotique a été ajouté, il n'y avait pas de différence de température rectale entre les groupes.
Pharmacocinétique et environnement
Après application sur la peau, la flunixine est modérément absorbée à travers la peau des bovins (biodisponibilité d’environ 44 %). Chez les bovins (excepté les veaux), les volumes de distribution sont généralement bas en raison du taux élevé (approximativement 99 %) de fixation aux protéines plasmatiques. Le temps apparent de demi-vie d’élimination plasmatique suivant l’application est d’environ 7-8 heures. La métabolisation de la flunixine est plutôt limitée, la plus grande partie du médicament correspond au composé parental non modifié, et les autres métabolites sont des dérivés hydroxylés. Chez les bovins, l’élimination a lieu principalement par excrétion biliaire.
Après application en pour-on, l’absorption de la flunixine est plus rapide à des températures extérieures élevées qu’à des températures faibles. Le Tmax est d’environ 2 heures en conditions chaudes (température entre 13°C et 30°C), tandis qu’en conditions froides, il est de 6 heures (températures comprises entre - 3°C et 7°C).
L’effet antipyrétique a été démontré dès 4 heures après l’application du médicament vétérinaire.
Données pharmaceutiques
Incompatibilités majeures
En l’absence d’études de compatibilité, ce médicament vétérinaire ne doit pas être mélangé avec d’autres médicaments vétérinaires.
Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 2 ans.
.
Température de conservation après ouverture
Durée de conservation après première ouverture du conditionnement primaire : 6 mois
Température de conservation
Ce médicament vétérinaire ne nécessite pas de conditions particulières de conservation.
Tenir hors de la vue et de la portée des enfants.
Précautions particulières de conservation selon pertinence
Ce médicament vétérinaire ne nécessite pas de conditions particulières de conservation.
Précautions particulières à prendre lors de l'élimination de médicaments non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Utiliser les dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné.
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Nature et composition du conditionnement primaire
Flacon polyéthylène haute densité (PEHD) avec bouchon en polypropylène (PP) muni d’un joint laminé par induction détachable. Les flacons sont équipés d’un système de dosage gradué et sont fournis individuellement dans des boîtes carton.
Titulaire de l'autorisation de mise sur le marché
Présentations commercialisées et AMM
| Présentation | Numéro d'autorisation de mise sur le marché | Date de première mise sur le marché (ou AMM) | Date de fin de commercialisation | Classement du médicament en matière de délivrance | Accessible aux groupements | GTIN |
|---|---|---|---|---|---|---|
| FINADYNE TRANSDERMAL® 50 mg/mL Boîte de 1 flacon de 250 mL | FR/V/9151586 5/2014 | 4/1/2014 | Soumis à prescription | Non | 08713184135872 | |
| FINADYNE TRANSDERMAL® 50 mg/mL Boîte de 1 flacon de 100 mL | FR/V/9151586 5/2014 | 4/1/2014 | Soumis à prescription | Non | 08713184135896 | |
| FINADYNE TRANSDERMAL® 50 mg/mL Boîte de 1 flacon de 1 litre | FR/V/9151586 5/2014 | 4/1/2014 | Soumis à prescription | Non | 08713184135889 |
