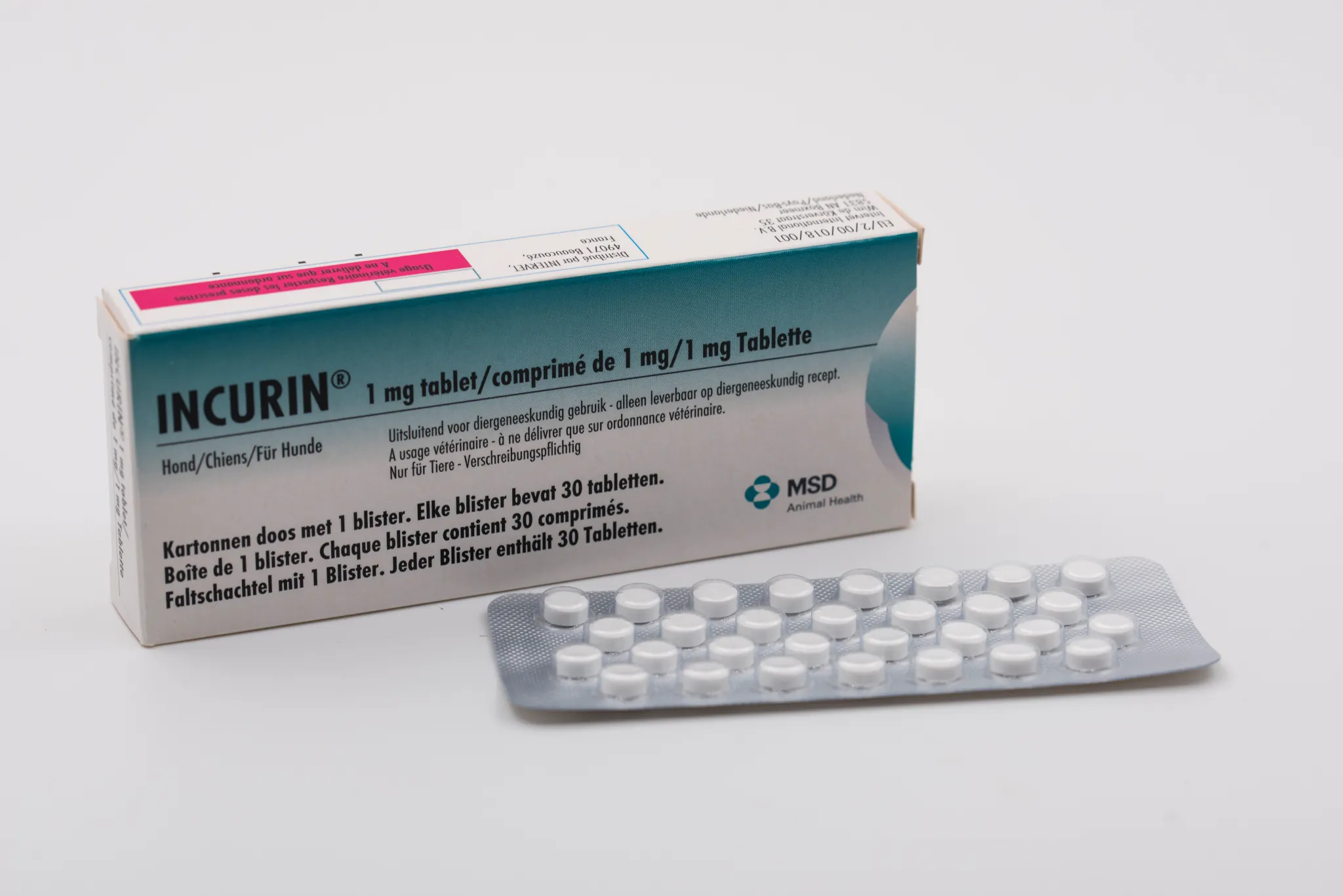
Composition
Principes actifs et excipients
Principes actifs
| Nom du principe actif | Quantité de principe actif |
|---|---|
| Estriol | 1 mg |
Excipients
| Nom de l'excipient |
|---|
| Amylopectine |
| Amidon de pomme de terre |
| Stéarate de magnésium |
| Lactose |
Informations complémentaires
Chaque comprimé contient :
Substance active:
Estriol 1 mg
Excipients:
| Composition qualitative en excipients et autres composants |
| Amylopectine |
| Amidon de pomme de terre |
| Stéarate de magnésium |
| Lactose |
Comprimés ronds sécables.
Clinique
Indications d'utilisation par espèce
- Chienne
Traitement de l'incontinence urinaire hormono-dépendante due à un dysfonctionnement du sphincter vésical chez les chiennes ovariohystérectomisées.
Voie d'administration et posologie
Voie d'administration
- Orale
Posologie
- Chienne
Voie orale uniquement.
Aucune relation existant entre la dose finale efficace et le poids corporel n'a été établie. La dose doit être déterminée individuellement pour chaque chienne.
Le programme de traitement suivant est conseillé : commencer le traitement avec 1 comprimé (1 mg d'estriol) par jour. Si le traitement est efficace, réduire la dose à un demi-comprimé par jour. Si le traitement n'est pas efficace, augmenter la dose à 2 comprimés par jour à administrer en une prise. Certaines chiennes n'ont pas besoin d'une administration quotidienne ; une administration tous les deux jours peut être envisagée une fois la dose journalière déterminée.
La dose minimale ne devrait pas être inférieure à 0,5 mg par chienne par jour. S'assurer que la dose utilisée pour obtenir l'effet thérapeutique est la plus petite possible. Ne pas administrer plus de 2 comprimés par chienne par jour. Si aucune réponse au traitement n'a été obtenue, le diagnostic devra être reconsidéré afin de trouver d'autres causes à l'incontinence telles que des désordres neurologiques, cancer de la vessie, etc.
Les animaux doivent être réexaminés tous les 6 mois pendant le traitement.
Temps d'attente
Complément d'information temps d'attente
Sans objet.
Contre indications
Ne pas utiliser chez les chiennes entières car l’efficacité a été établie uniquement chez la chienne ovariohysterectomisée.
Les animaux présentant des symptômes de polyurie-polydipsie ne doivent pas être traités avec ce médicament vétérinaire.
L’utilisation de ce médicament vétérinaire est contre-indiquée pendant la gestation et la lactation et chez les chiennes âgées de moins d’un an.
Mises en garde particulières à chaque espèce cible
De fortes doses d'œstrogène peuvent induire un effet promoteur tumoral au niveau des organes cibles comportant des récepteurs aux œstrogènes (glandes mammaires).
Précautions particulières d'emploi
Précautions particulières pour une utilisation sûre chez les espèces cibles
En cas d'effets oestrogéniques, la dose doit être réduite.
Précautions particulières à prendre par la personne qui administre le médicament
Sans objet.
Précautions particulières concernant la protection de l'environnement
Sans objet.
Autres précautions
Aucune.
Interactions médicamenteuses et autres formes d'interaction
Aucune connue.
Utilisation en cas de gravidité de lactation ou de ponte
Ne pas utiliser durant la gestation et la lactation.
Effets indésirables
Chiens (chiennes) :
Très fréquent (>1 animal / 10 animaux traités) : | Gonflement vulvaire1,2, Œdème mammaire1,2 ; Attraction des mâles1,2 ; Vomissements1,2 |
Rare (1 à 10 animaux / 10 000 animaux traités) : | Saignements vaginaux ; Alopécie |
1 Observés à la dose recommandée la plus élevée de 2 mg par chien.
2 Ces effets sont réversibles après réduction de la dose.
Il est important de notifier les effets indésirables. La notification permet un suivi continu de l’innocuité d’un médicament vétérinaire. Les notifications doivent être envoyées, de préférence par l’intermédiaire d’un vétérinaire, soit au titulaire de l’autorisation de mise sur le marché, soit à l’autorité nationale compétente par l’intermédiaire du système national de notification. Voir la notice pour les coordonnées respectives.
Surdosage (symptômes, conduite d’urgences, antidotes)
En cas de surdosage, des effets de type oestrogénique peuvent être observés. Ces effets sont réversibles après réduction de la dose.
Informations pharmacologiques ou immunologiques
codes ATC
QG03CA04 : estriol
Pharmacodynamie
L'estriol est un œstrogène naturel à courte durée d'action. Il a un effet bénéfique sur l’incontinence urinaire chez les chiennes ovariectomisées. Lors des études de tolérance chez l’animal de destination et des essais cliniques incluant des traitements de longue durée, aucun signe d’aplasie médullaire n’a été observé. Ce point positif est probablement dû à la courte durée d'action oestrogénique de l’estriol.
Pharmacocinétique et environnement
Après administration orale, l’estriol est presque entièrement absorbé au niveau du tractus gastro-intestinal. La majeure partie de l’estriol est liée à l’albumine plasmatique. L’estriol est excrété conjugué dans l’urine.
Il n’y a pas d'accumulation après administration orale répétée.
Données pharmaceutiques
Incompatibilités majeures
Aucune connue.
Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 3 ans.
Température de conservation
À conserver à une température ne dépassant pas 30º C.
Précautions particulières de conservation selon pertinence
À conserver à une température ne dépassant pas 30º C.
Précautions particulières à prendre lors de l'élimination de médicaments non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Utiliser les dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné.
Nature et composition du conditionnement primaire
Plaquette en PVC transparent doublé d'une feuille d'aluminium et scellé par une couche en vinyle copolymère sur la face en contact avec les comprimés. Une plaquette contient 30 comprimés.
Taille de l’emballage : boîte de 1 plaquette.
Titulaire de l'autorisation de mise sur le marché
Présentations commercialisées et AMM
| Présentation | GTIN | Numéro d'autorisation de mise sur le marché | Date de première mise sur le marché (ou AMM) | Classement du médicament en matière de délivrance | Accessible aux groupements |
|---|---|---|---|---|---|
| INCURIN® Boîte de 1 plaquette thermoformée de 30 comprimés | 08713184154095 | EU/2/00/018/001 | 3/24/2000 | Soumis à prescription | Non |
