Trilorale 10 mg/ml suspension buvable pour chiens
AXIENCE S.A.S.Suspension buvable
Composition
Principes actifs et excipients
Principes actifs
| Nom du principe actif | Quantité de principe actif |
|---|---|
| Trilostane | 10 mg/mL |
Excipients
| Nom de l'excipient | Quantité de l'excipient |
|---|---|
| Benzoate de Sodium | 1.5 mg/mL |
Informations complémentaires
Suspension de couleur blanche à blanc cassé.
Clinique
Indications d'utilisation par espèce
- Chien
Traitement de l’hypercorticisme d'origine hypophysaire ou d’origine surrénalienne (maladie et syndrome de Cushing surrénalien) chez le chien.
Voie d'administration et posologie
Voie d'administration
- Orale
Posologie
- Chien
Voie orale, une fois par jour, au moment du repas, et directement dans la bouche du chien.
La dose initiale du traitement est d’environ 2 mg/kg. Elle doit être ajustée en fonction de la réponse individuelle, telle que déterminée par le suivi (voir ci-après). S’il convient d’augmenter la dose journalière, il convient de le faire de manière progressive et d’administrer la plus petite dose nécessaire pour contrôler les signes cliniques.
Trilorale 10 mg/ml suspension buvable pour chiens ne doit pas être administré à des doses supérieures à 2 mg de trilostane/kg de poids corporel. Pour les chiens nécessitant des doses supérieures à 2 mg de trilostane/kg, il convient d’utiliser Trilorale 50 mg/ml suspension buvable pour chiens. Voir la rubrique 3.5 «Précautions particulières pour une utilisation sûre chez les espèces cibles».
Enfin, si les symptômes ne sont pas contrôlés de manière satisfaisante sur une période complète de 24 heures entre deux doses, il convient d’augmenter la dose totale de 50 % (au maximum) et de la répartir en deux prises journalières égales (matin et soir).
Un petit nombre d’animaux peut nécessiter une posologie supérieure à 10 mg/kg de poids corporel/j. Dans de telles situations, il conviendra de suivre les animaux de manière encore plus attentive.
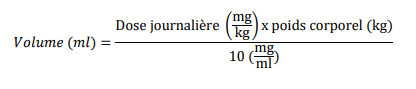
La dose peut être calculée comme suit:
Suivi :
À la suite du diagnostic initial et après chaque ajustement de la posologie, le praticien effectuera, préalablement au traitement, à 10 jours, à 4 semaines, à 12 semaines, puis tous les 3 mois, des prélèvements sanguins pour des analyses biochimiques (y compris le dosage des électrolytes) et un test de stimulation de la cortisolémie à l’ACTH. Il est impératif de réaliser un test de stimulation de la cortisolémie à l’ACTH 4 à 6 heures après l’administration du médicament pour permettre une interprétation précise des résultats. Il est préférable d’administrer la dose requise le matin pour permettre au vétérinaire d’effectuer les tests de suivi 4 à 6 heures après l’administration. Une évaluation régulière de l’évolution clinique de la maladie doit également être effectuée à chacun des moments susmentionnés.
Dans le cas d’une absence de réponse de la cortisolémie à une stimulation à l’ACTH lors d’un contrôle sanguin, le traitement devra être arrêté pendant 7 jours, puis repris à une dose plus faible. Le test à l’ACTH devra être réalisé à nouveau 14 jours plus tard. En cas de nouvelle absence de réponse à la stimulation, le traitement devra être suspendu jusqu’à la réapparition des signes cliniques d’hyperadrénocorticisme. Le test à l’ACTH devra être réalisé à nouveau un mois après la reprise du traitement.
Bien agiter avant utilisation.
Temps d'attente
Complément d'information temps d'attente
Sans objet.
Contre indications
Ne pas utiliser chez les animaux souffrant d’une affection hépatique primaire et/ou d’une insuffisance rénale.
Ne pas utiliser en cas d’hypersensibilité à la substance active ou à l’un des excipients.
Mises en garde particulières à chaque espèce cible
Un diagnostic précis d’hypercorticisme est essentiel.
En l’absence de réponse au traitement, le diagnostic devra être réévalué. Des augmentations de doses peuvent s’avérer nécessaires.
Les vétérinaires doivent être vigilants sur le fait que les chiens atteints d’hypercorticisme présentent un risque accru de pancréatite. Ce risque pourrait ne pas être diminué après un traitement au trilostane.
Précautions particulières d'emploi
Précautions particulières pour une utilisation sûre chez les espèces cibles
Comme la majorité des cas d’hypercorticisme concerne des chiens âgés de 10 à 15 ans, d’autres affections concomitantes sont souvent présentes. Il est particulièrement important de vérifier l’absence d’affection hépatique primitive ou d'insuffisance rénale, étant donné que le produit est contre-indiqué dans ces situations.
Une surveillance étroite devra être réalisée pendant le traitement. Une attention particulière sera prêtée aux enzymes hépatiques, aux électrolytes, à l’urée et à la créatinine. La présence simultanée d’un diabète sucré et d’un hypercorticisme requiert une surveillance spécifique.
Si un chien a reçu un traitement préalable par mitotane, sa fonction surrénalienne peut être réduite.
Dans ce cas, l’expérience suggère de respecter un intervalle d’au moins un mois entre l’arrêt du mitotane et le début du traitement avec le trilostane. Un suivi rigoureux de la fonction surrénalienne est alors conseillé, car les chiens peuvent être plus sensibles aux effets du trilostane.
Le médicament vétérinaire doit être utilisé avec une extrême précaution chez les chiens atteints d’une anémie préexistante, dans la mesure où une réduction supplémentaire de l’hématocrite et de l’hémoglobinémie peut survenir. Des contrôles réguliers devront être réalisés.
Le médicament vétérinaire contient l’excipient xylitol, qui peut causer des effets indésirables s’il est administré à des doses élevées. L’administration de Trilorale 10 mg/ml suspension buvable pour chiens à des doses supérieures à 2 mg de trilostane/kg de poids corporel peut conduire à la toxicité du xylitol. Pour atténuer ce risque chez les chiens nécessitant des doses supérieures à 2 mg de trilostane/kg, il convient d’utiliser Trilorale 50 mg/ml suspension buvable pour chiens.
Précautions particulières à prendre par la personne qui administre le médicament
Le trilostane peut diminuer la synthèse de la testostérone et possède des propriétés anti-progestatives. Les femmes enceintes ou ayant l’intention de le devenir doivent éviter de manipuler le médicament vétérinaire.
Il convient de se laver les mains au savon et à l’eau après chaque utilisation et en cas d’exposition accidentelle.
Le médicament vétérinaire peut provoquer une irritation et une sensibilisation de la peau et des yeux. En cas de contact accidentel de la suspension avec la peau ou les yeux, il est impératif de laver abondamment à l’eau et sans attendre la zone concernée. Si l’irritation persiste, consulter un médecin.
Les personnes présentant une hypersensibilité connue au trilostane, à la vanilline ou au benzoate de sodium doivent éviter tout contact avec le médicament vétérinaire.
Une ingestion accidentelle peut avoir des effets nocifs (nausées, vomissements et diarrhée, notamment). Des précautions doivent donc être prises pour éviter une ingestion accidentelle du médicament, en particulier par un enfant. Les seringues remplies et usagées sont à conserver hors de la vue et de la portée des enfants. En cas d’ingestion accidentelle, demandez immédiatement conseil à un médecin et montrez-lui la notice ou l’étiquette.
Précautions particulières concernant la protection de l'environnement
Sans objet.
Autres précautions
Sans objet.
Interactions médicamenteuses et autres formes d'interaction
Les possibilités d’interactions avec d’autres médicaments n’ont pas été spécifiquement étudiées. Étant donné que l’hyperadrénocorticisme touche principalement les chiens âgés, nombre d’entre eux recevront des traitements concomitants. Les études cliniques n’ont montré aucune interaction. Le risque d’apparition d’une hyperkaliémie doit être pris en compte si le trilostane est utilisé en combinaison avec des diurétiques épargneurs potassiques ou des inhibiteurs de l’enzyme de conversion de l’angiotensine (IECA). L’utilisation concomitante de tels médicaments doit faire l’objet d’une évaluation du rapport bénéfice/risque par le vétérinaire, car quelques décès de chiens traités concomitamment avec du trilostane et un IECA ont été rapportés (morts subites, notamment).
Utilisation en cas de gravidité de lactation ou de ponte
Gestation et lactation
Ne pas utiliser chez les chiennes gestantes ou allaitantes.
Fertilité
Ne pas utiliser sur les animaux destinés à la reproduction.
Effets indésirables
Chiens :
Peu fréquent (1 à 10 animaux / 1 000 animaux traités) : | Léthargie2, anorexie2, vomissements2, diarrhée2 |
Rare (1 à 10 animaux / 10 000 animaux traités) : | Hypoadrénocorticisme, hypersalivation. Ballonnements, ataxie, tremblements musculaires, affections cutanées, insuffisance rénale3 et arthrite3 |
Très rare (<1 animal / 10 000 animaux traités, y compris les cas isolés) : | Faiblesse2, nécrose des surrénales1 et mort subite |
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) : | Crise addisonienne aiguë (choc) |
1 Peut entraîner un hypoadrénocorticisme.
2 Ces signes associés à un hypoadrénocorticisme iatrogène peuvent survenir, en particulier si la surveillance n’est pas adéquate (voir rubrique 3.9). Les signes sont généralement réversibles dans un délai variable après l’arrêt du traitement.
Des cas de léthargie, de vomissements, de diarrhée et d’anorexie ont été observés chez des chiens traités par trilostane en l’absence de signes d’hypoadrénocorticisme.
3 Peut être révélé par le traitement.
Le traitement peut révéler une arthrite due à une réduction des niveaux de corticostéroïdes endogènes.
Il est important de notifier les effets indésirables. La notification permet un suivi continu de l’innocuité d’un médicament vétérinaire. Les notifications doivent être envoyées, de préférence par l’intermédiaire d’un vétérinaire, soit au titulaire de l’autorisation de mise sur le marché, soit à l’autorité nationale compétente par l’intermédiaire du système national de notification. Voir la notice pour les coordonnées respectives.
Surdosage (symptômes, conduite d’urgences, antidotes)
Un surdosage peut conduire à des signes d’hypoadrénocorticisme (léthargie, anorexie, vomissements, diarrhée, signes cardiovasculaires, choc). Il n’y a pas eu de cas de mortalité après l’administration chronique de doses de 36 mg/kg chez des chiens en bonne santé. Néanmoins, la mort peut survenir si des doses plus importantes sont administrées à des chiens atteints d’hyperadrénocorticisme.
Il n’existe pas d’antidote spécifique pour le trilostane. Il est nécessaire d’interrompre le traitement et d’instaurer un traitement de soutien incluant des corticoïdes, une correction des déséquilibres électrolytiques et une fluidothérapie, en fonction des signes cliniques.
En cas de surdosage aigu, il peut être bénéfique de provoquer des vomissements, suivis de l’administration de charbon activé.
Toute insuffisance corticosurrénale iatrogène est en général rapidement réversible une fois le traitement interrompu. Cependant, ces effets peuvent se prolonger chez un faible pourcentage de chiens. Après un arrêt du traitement par trilostane d’une semaine, celui-ci pourra être repris avec une dose réduite.
Antimicrobiens et antiparasitaires : lutte contre les résistances
Sans objet.
Informations pharmacologiques ou immunologiques
codes ATC
QH02CA01 : trilostane
Pharmacodynamie
Le trilostane est un inhibiteur sélectif et réversible du système enzymatique 3 bêta-hydroxystéroïde déshydrogénase, bloquant ainsi la synthèse de cortisol, de corticostérone et d’aldostérone. Lorsqu’il est utilisé pour traiter l’hyperadrénocorticisme, il réduit la production de glucocorticoïdes et de stéroïdes minéralocorticoïdes dans le cortex surrénal. Les concentrations circulantes en stéroïdes sont donc réduites. Le trilostane s’oppose également à l’activité de l’hormone adrénocorticotrope exogène (ACTH). Il n’a aucun effet direct sur le système nerveux central ni sur le système cardiovasculaire.
Pharmacocinétique et environnement
Les données pharmacocinétiques chez le chien ont montré une grande variabilité inter-individuelle. Dans une étude pharmacocinétique menée sur des beagles de laboratoire, l’aire sous la courbe (ASC) se situait entre 52 et 281 microgrammes/mL/min chez les chiens nourris et entre 16 et 175 microgrammes/ml/min chez les chiens à jeun. Généralement, le trilostane est rapidement éliminé du plasma avec des concentrations plasmatiques atteignant un maximum à 0,5-2,5 heures et revenant presque au niveau de base 6 à 12 heures après l’administration. Le principal métabolite actif du trilostane, le kétotrilostane, suit un schéma similaire. De plus, aucune preuve d’accumulation dans le temps du trilostane ou de ses métabolites n’a été décelée. Dans le cadre d’une étude portant sur la biodisponibilité du trilostane par voie orale chez le chien, il a été démontré que le trilostane est mieux absorbé lorsqu’il est administré pendant un repas.
Chez le rat, il a été démontré que le trilostane est excrété principalement dans les fèces, ce qui indique que l’excrétion biliaire est la principale voie métabolique. Chez le singe, le trilostane est excrété en quantités égales dans les fèces et les urines. Les résultats ont montré que le trilostane est rapidement et bien absorbé par le tractus gastro-intestinal, tant chez le rat que chez le singe, et qu’il s’accumule dans les glandes surrénales chez le rat.
Données pharmaceutiques
Incompatibilités majeures
En l’absence d’études de compatibilité, ce médicament vétérinaire ne doit pas être mélangé avec d’autres médicaments vétérinaires.
Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente: 3 ans
Durée de conservation après première ouverture du conditionnement primaire: 6 mois
Durée de conservation après ouverture
Durée de conservation après première ouverture du conditionnement primaire: 6 mois
Température de conservation après ouverture
Ce médicament vétérinaire ne nécessite pas de conditions particulières de conservation en ce qui concerne la température.
Température de conservation
Ce médicament vétérinaire ne nécessite pas de conditions particulières de conservation en ce qui concerne la température.
Précautions particulières à prendre lors de l'élimination de médicaments non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Utiliser les dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné.
Nature et composition du conditionnement primaire
Flacon en polyéthylène haute densité muni d’un dispositif de fermeture en polypropylène/polyéthylène haute densité avec sécurité enfants et d’un bouchon en polyéthylène dans une boîte en carton.
Titulaire de l'autorisation de mise sur le marché
Présentations commercialisées et AMM
| Présentation | GTIN | Numéro d'autorisation de mise sur le marché | Date de première mise sur le marché (ou AMM) | Classement du médicament en matière de délivrance | Accessible aux groupements |
|---|---|---|---|---|---|
| Flacon de 30 mL et une seringue de mesure en polypropylène de 1 mL et de 5 mL | 03760087153835 | EU/2/24/313/001 | 5/6/2024 | Soumis à prescription | Non |
