
VERAFLOX® 25 mg/mL Suspension buvable pour chats
ELANCO FRANCESuspension
Composition
Principes actifs et excipients
Principes actifs
| Nom du principe actif | Quantité de principe actif |
|---|---|
| Pradofloxacine | 25 mg/mL |
Excipients
| Nom de l'excipient | Quantité de l'excipient |
|---|---|
| Conservateur acide sorbique (E200) | 2 mg |
| Amberlite IRP 64 | |
| Acide sorbique | |
| Acide ascorbique | |
| Gomme xanthane | |
| Propylène glycol | |
| Arome vanille | |
| Eau purifiée |
Informations complémentaires
Suspension buvable Suspension de couleur jaunâtre à beige.
Clinique
Indications d'utilisation par espèce
- Chat
Traitement des :
- Infections aiguës des voies respiratoires supérieures dues à des souches de Pasteurella multocida, Escherichia coli et du groupe Staphylococcus intermedius (y compris S. pseudintermedius).
- Infections des plaies et abcès dus à des souches du groupe Staphylococcus intermedius (y compris S. pseudintermedius), Pasteurella multocida.
Voie d'administration et posologie
Voie d'administration
- Orale
Posologie
- Chat
Voie orale.
La dose recommandée est de 5 mg de pradofloxacine par kg de poids corporel une fois par jour. En fonction de la graduation de la seringue, la dose se situe entre 5 et 7,5 mg/kg de poids corporel selon le tableau suivant :
Poids corporel
(kg)Dose suspension buvable
(ml)>0,67 – 1
0,2
>1 – 1,5
0,3
>1,5 – 2
0,4
>2 – 2,5
0,5
>3 – 3,5
0,7
>3,5 - 4
0,8
>4 -5
1
>5 - 6
1,2
>6 -7
1,4
>7 - 8
1,6
>8 - 9
1,8
>9 - 10
2
Afin d’assurer un dosage correct, le poids corporel devra être déterminé avec autant de précision que possible pour éviter tout sous dosage.
Durée du traitement
La durée du traitement est fonction de la nature et de la sévérité de l’infection ainsi que de la réponse au traitement. Pour la plupart des infections, les durées suivantes seront suffisantes :
Indication
Durée du traitement (jours)
Infections des plaies et des abcès 7
Infections aiguës des voies respiratoires supérieures 5
Le traitement devra être revu en l'absence d'amélioration des troubles après 3 jours de traitement.
Méthode d’administration
Pour faciliter l’administration de la dose exacte, une seringue de 3 ml (graduée de 0,1 à 2 ml) pour administration orale est fournie avec le flacon de 15 ml de la suspension buvable de Veraflox.
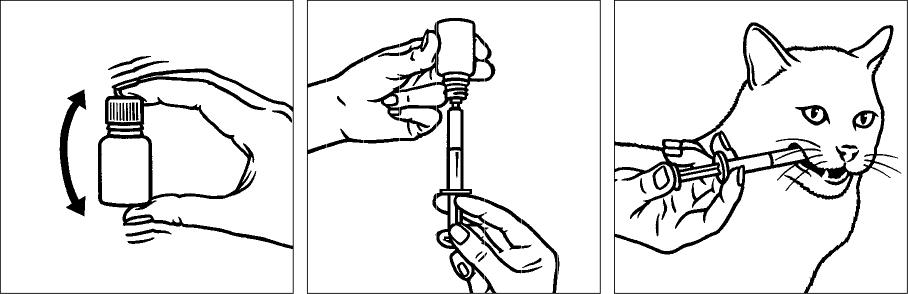

Pour éviter toute contamination croisée, veiller à ne pas utiliser la même seringue pour plusieurs animaux : une seule seringue par animal traité. Après administration, nettoyer la seringue à l’eau du robinet et la ranger dans la boite en carton avec le produit.
Temps d'attente
Complément d'information temps d'attente
Toutes cibles :
Sans objet.
Contre indications
Ne pas utiliser chez des chats présentant une hypersensibilité connue aux fluoroquinolones.
Ne pas utiliser chez les chatons âgés de moins de 6 semaines.
La pradofloxacine n’a pas d’effet sur le cartilage en dévelopement des chatons âgés de 6 semaines et plus. Ne pas utiliser chez les chats présentant des lésions persistantes du cartilage articulaire, car les lésions peuvent s'aggraver pendant le traitement par les fluoroquinolones.
Ne pas utiliser chez les chats atteints de troubles du système nerveux central (SNC) comme l’épilepsie, les fluoroquinolones étant susceptibles d’induire des convulsions chez les animaux prédisposés.
Ne pas utiliser chez les chattes gestantes ou allaitantes (voir rubrique 3.7).
Mises en garde particulières à chaque espèce cible
Une résistance croisée a été démontrée entre la pradofloxacine et d'autres fluoroquinolones. L'utilisation de la pradofloxacine doit être soigneusement envisagée lorsque l'antibiogramme a révélé une résistance aux fluoroquinolones, car son efficacité peut être réduite.
Précautions particulières d'emploi
Précautions particulières pour une utilisation sûre chez les espèces cibles
L'utilisation du produit doit être basée sur l'identification et l'antibiogramme du ou des pathogènes cibles. Si cela n'est pas possible, le traitement devrait être fondé sur des informations épidémiologiques et sur la connaissance de la sensibilité des agents pathogènes cibles.
L'utilisation du produit doit être conforme aux politiques antimicrobiennes officielles, nationales et régionales.
Un antibiotique présentant un risque moindre de sélection de la résistance aux antimicrobiens (catégorie AMEG inférieure) devrait être utilisé pour le traitement de première intention lorsque les tests de sensibilité suggèrent l'efficacité probable de cette approche. Une antibiothérapie à spectre étroit présentant un risque moindre de sélection de la résistance aux antimicrobiens devrait être utilisée pour le traitement de première intention lorsque les antibiogrammes suggèrent l'efficacité probable de cette approche
La pradofloxacine peut augmenter la sensibilité aux rayonnements solaires. Il est conseillé d’éviter une exposition excessive au soleil pendant le traitement.
Précautions particulières à prendre par la personne qui administre le médicament
Les personnes présentant une hypersensibilité connue aux fluoroquinolones doivent éviter tout contact avec le produit.
Eviter le contact avec la peau et les yeux. Se laver les mains après utilisation.
En cas de contact accidentel avec les yeux, rincer immédiatement à l’eau.
En cas de contact avec la peau, rincer à l’eau.
Ne pas manger, boire ou fumer pendant la manipulation du produit.
En cas d’ingestion accidentelle, rechercher un avis médical et montrer la notice ou l’étiquette du produit à un médecin.
Précautions particulières concernant la protection de l'environnement
Sans 'objet.
Autres précautions
Sans object.
Interactions médicamenteuses et autres formes d'interaction
Une administration concomitante avec des cations métalliques tels que ceux présents dans les antiacides ou scralfate à base d’hydroxyde de magnésium ou d’hydroxyde d’aluminium, ou avec une association de vitamines contenant du fer ou du zinc ou encore des produits laitiers contenant du calcium entraîne une diminution significative de la biodisponibilité des fluoroquinolones. Par conséquent, ne pas utiliser ce médicament vétérinaire lors de l’administration d’un antiacide, de sucralfate, de fer, d’aluminium ou de calcium, ou en cas de consommation de produits laitiers, l’absorption de ce médicament vétérinaire pouvant s’en trouver diminuée.
De plus, les fluoroquinolones ne doivent pas être utilisées en association avec des anti-inflammatoires non-stéroidiens (AINS) chez les animaux ayant eu des convulsions en raison des interactions pharmacodynamiques potentielles sur le SNC. L’association de fluoroquinolones avec la théophylline peut augmenter la teneur plasmatique en théophylline en altérant son métabolisme et est par conséquent, à éviter. L’utilisation combinée des fluoroquinolones avec la digoxine doit également être évitée en raison de l’augmentation potentielle de la biodisponiblité orale de la digoxine.
Utilisation en cas de gravidité de lactation ou de ponte
La sécurité du médicament vétérinaire n’a pas été établie en cas de gravidité et de lactation.
Gestation :
Ne pas utiliser pendant tout ou partie de la gestation. Des études de laboratoire chez le rat ont mis en évidence des malformations oculaires induites par la pradofloxacine à des doses fœtotoxiques et maternotoxiques.
Lactation :
Ne pas utiliser pendant la lactation étant donné qu’aucune donnée n’est disponible sur la pradofloxacine chez les chatons de moins de 6 semaines. Il est connu que les fluoroquinolones traversent le placenta et sont distribuées dans le lait.
Fertilité :
Il a été démontré sur des animaux d’élevage que la pradofloxacine n’a pas d’effet sur la fertilité.
Effets indésirables
Rare (1 à 10 animaux / 10 000 animaux traités) : | Troubles digestifs (par exemple vomissements) 1. |
1 Léger et transitoire
Surdosage (symptômes, conduite d’urgences, antidotes)
Aucun antidote spécifique de la pradofloxacine (ou d’une autre fluoroquinolone) n’est connu, en conséquence, dans le cas d’un surdosage, un traitement symptomatique doit être administré.
Des vomissements intermittents ont été observés après administration orale répétée de 1,6 fois la dose maximale recommandée.
Antimicrobiens et antiparasitaires : lutte contre les résistances
Sans objet.
Informations pharmacologiques ou immunologiques
codes ATC
QJ01MA97 : pradofloxacine
Pharmacodynamie
Mode d’action
Le principal mode d’action des fluoroquinolones repose sur une interaction avec des enzymes qui sont essentielles aux fonctions majeures de l’ADN comme la réplication, la transcription et la recombinaison. Les cibles principales de la pradofloxacine sont l’ADN-gyrase et la topoisomérase IV des bactéries. Une association réversible entre la pradofloxacine et l’ADN-gyrase ou l’ADN-topoisomérase IV de la bactérie cible entraîne une inhibition sélective de ces enzymes et la mort rapide de la cellule bactérienne. La rapidité et l’ampleur de l’effet bactéricide sont directement proportionnelles à la concentration du médicament.
Spectre antibactérien
Bien que l’activité in-vitro de la pradofloxacine couvre un large spectre de germes Gram positif et Gram négatif y compris des bactéries anaérobies, elle doit être utilisée uniquement pour les indications approuvées (voir rubrique 3.2) et en conformité avec les recommandations d’utilisation de la rubrique 3.5 du Résumé de Caractéristiques du Produit (RCP).
Données CMI
| Espèces bactériennes | Nombre de souches | CMI50 | CMI90 (mcg/ml) | CMI (mcg/ml) |
| Pasteurella multocida – infection des voies respiratoires1 | 64 | 0.0160.008 | 0,08 | 0.0,04-0.03 |
| Pasteurella multocida – infections de la plaie 2 | 42 | 0.008 | 0.008 | 0,004 – 0,03 |
| Escherichia coli - infection des voies respiratoires1 | 22 | 0.015 | 4 | 0.008-8 |
| Groupe Staphylococcus intermedius (y compris S. pseudintermedius - infection des voies respiratoires1 | 25 | 0,12 | 2 | 0,008-4 |
| Groupe Staphylococcus intermedius (y compris S. pseudintermedius) – infection de la plaie2 | 20 | 0.03 | 2 | 0,15 – 2 |
1 Données collectées entre 2017-2018
2 Données collectées entre 2017-2018
Les bactéries ont été isolées à partir de cas cliniques en Belgique, République Tchèque, France, Allemagne, Hongrie, Italie, Pologne, Espagne, Suède, Suisse et Royaume-Uni.
Les points de rupture cliniques établis par le CLSI en 2024 (7e édition) pour la pradofloxacine chez les chats pour les infections des voies respiratoires sont les suivants :
Organisme | Concentration minimale inhibitrice points de rupture de la pradofloxacine (mcg/ml) | ||
sensible | intermediaire | resistant | |
E. coli | ≤0.25 | 0,5-1 | ≥2 |
S. pseudintermedius | ≤0.25 | 0,5-1 | ≥2 |
Types et mécanismes de résistance
Il a été observé que la résistance aux fluoroquinolones avait cinq sources principales : (i) mutations ponctuelles dans les gènes codant pour l’ADN gyrase et/ou topoisomérase IV conduisant à des altérations de l’enzyme correspondante, (ii) modifications de la perméabilité des bactéries Gram-négatif aux médicaments, (iii) mécanismes d’efflux, (iv) résistance à médiation plasmidique et (v) protéines de protection de la gyrase. Ces mécanismes entraînent une diminution de la sensibilité des bactéries aux fluoroquinolones. La résistance croisée au sein de la classe des fluoroquinolones des antimicrobiens est courante.
Pharmacocinétique et environnement
Dans les études de laboratoire, la biodisponibilité de la pradofloxacine chez les chats nourris était réduite par rapport à celle des animaux à jeun. Toutefois, lors des études cliniques, l’alimentation n’a pas impacté l’effet du traitement.
Après administration orale de la dose thérapeutique de la spécialité chez le chat, la pradofloxacine est rapidement absorbée et atteint un pic de concentration de 2,1 mg/l dans l’heure qui suit l’administration. La biodisponibilité de la spécialité est d’au minimum 60%. Une administration répétée est sans impact sur le profil pharmacocinétique (indice d’accumulation = 1,2). La liaison aux protéines plasmatiques in vitro est modérée (30 %). L’important volume de distribution, supérieur à 4 l/kg de poids corporel, reflète une bonne pénétration tissulaire. La pradofloxacine est éliminée du sérum avec un temps de demi-vie terminal de 7 heures. La pradofloxacine est principalement excrétée sous forme glucuronoconjuguée chez le chat. La clairance corporelle totale de la pradofloxacine est de 0,28 l/h/kg.
Données pharmaceutiques
Incompatibilités majeures
En l’absence d’étude de compatibilité, ne pas associer à d’autres médicaments vétérinaires.
Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 3 ans.
Durée de conservation après ouverture du flacon : 3 mois.
Température de conservation
À conserver dans le flacon d’origine.
Conserver le flacon correctement fermé.
Précautions particulières de conservation selon pertinence
Tenir hors de la vue et de la portée des enfants.
Ce médicament vétérinaire ne nécessite pas de conditions de conservation particulières.
Ne pas utiliser ce médicament vétérinaire après la date de péremption figurant sur la boîte et le blister après Exp. La date de péremption correspond au dernier jour du mois indiqué.
Précautions particulières à prendre lors de l'élimination de médicaments non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Utiliser des dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable. Ces mesures devraient contribuer à protéger l’environnement.
Demandez à votre vétérinaire ou à votre pharmacien comment éliminer les médicaments dont vous n’avez plus besoin.
Nature et composition du conditionnement primaire
Boîte contenant un flacon en polyéthylène haute densité (PEHD) blanc muni d’un adaptateur en polyéthylène et d’une fermeture de sécurité enfant.
Conditionnements disponibles : flacon de 15 ml avec seringue de 3ml et flacon de 30 ml.
Titulaire de l'autorisation de mise sur le marché
Présentations commercialisées et AMM
| Présentation | GTIN | Numéro d'autorisation de mise sur le marché | Date de première mise sur le marché (ou AMM) | Classement du médicament en matière de délivrance | Accessible aux groupements |
|---|---|---|---|---|---|
| VERAFLOX® 25 mg/mL Suspension buvable pour chats Boîte de 1 flacon de 15 mL muni d'un adaptateur et d'une fermeture de sécurité enfant | 04007221032076 | EU/2/10/107/013 | 4/12/2011 | Non |
Responsable de la mise sur le marché
Responsable de la Pharmacovigilance
ELANCO FRANCE
Crisco Uno, Bâtiment C
3-5 avenue de la Cristallerie
92310 Sèvres - France
Compléments d'informations
Date de mise à jour du RCP
4/23/2025Gamme thérapeutique
Gamme thérapeutique
AntibiotiquePathogènes (genre)
- Pasteurella
- Staphylococcus
- Escherichia
