Composition
Principes actifs et excipients
Principes actifs
| Nom du principe actif | Quantité de principe actif |
|---|---|
| Propentofylline | 50 mg/comprimé |
Excipients
| Nom de l'excipient | Quantité de l'excipient |
|---|---|
| Dioxyde de titane, (E171) | 0.215 mg/comprimé |
| Oxyde de fer, jaune, (E172) | 0.075 mg/comprimé |
Informations complémentaires
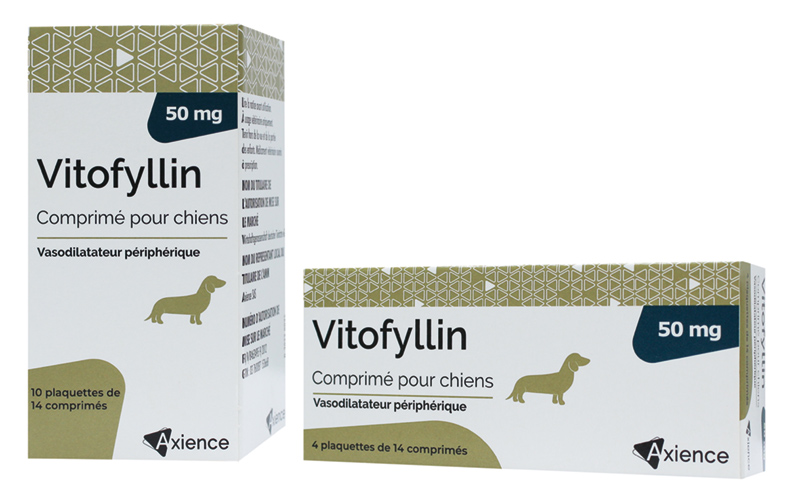
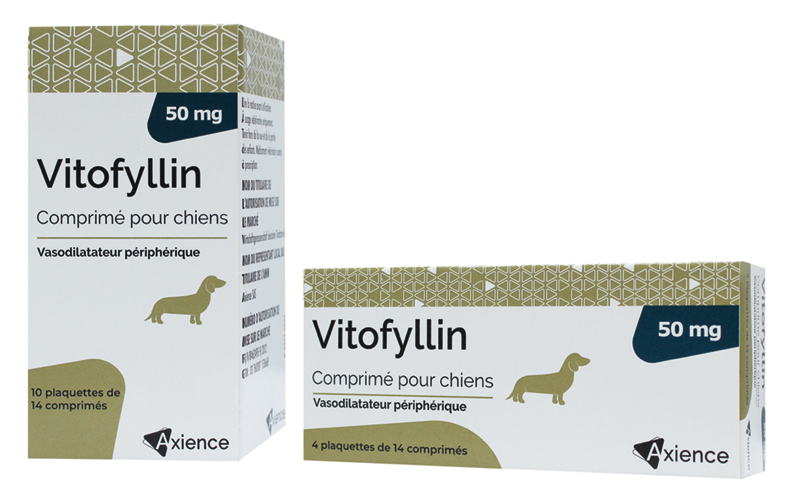
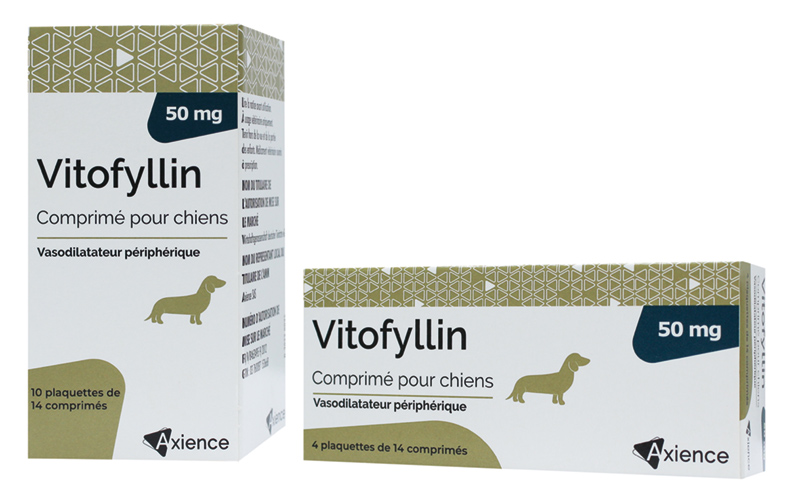
Comprimés pelliculés.
Comprimés jaunes, ronds, convexes, avec une barre de sécabilité en croix sur une face et portant l’inscription « 50 » sur l’autre.
Le comprimé est sécable en deux ou en quatre parties égales.
Clinique
Indications d'utilisation par espèce
- Chien
Chez les chiens :
- Amélioration de la circulation vasculaire périphérique et cérébrale. Amélioration de l'apathie, de la léthargie et des troubles du comportement des chiens.
Voie d'administration et posologie
Voie d'administration
- Orale
Posologie
- Chien
La posologie recommandée est de 6 à 10 mg de propentofylline par kg de poids vif par jour, administrée en 2 fois. L'administration journalière de 2 doses de 3 à 5 mg/kg se fait comme suit :
Afin d’assurer l’administration d’une dose correcte, le poids de l’animal doit être déterminé avant le traitement.
Poids(kg) Nombre de comprimé(s) Nombre total de comprimés par jour Dose totale journalière (mg/kg) matin soir 2,5 – 4 ¼ ¼ ½ 6,3 – 10,0 5 – 7 ½ ½ 1 7,1 – 10,0 8 – 9 ¾ ¾ 1 ½ 8,3 – 9,4 10 – 15 1 1 2 6,7 – 10,0 16 – 25 1½ 1½ 3 6,0 – 9,4 26 – 33 2 2 4 6,1 – 7,7
Les chiens de plus de 20 kg peuvent être traités avec VITOFYLLIN 100 MG COMPRIME POUR CHIENS.Les comprimés peuvent être déposés directement à l'arrière de la langue du chien ou mélangés à une boulette de nourriture. L'administration doit se faire au moins une demi-heure avant le repas.
Temps d'attente
Complément d'information temps d'attente
Sans objet.
Contre indications
Voir rubrique « Utilisation en cas de gravidité, de lactation ou de ponte ».
Ne pas utiliser chez les chiens pesant moins de 2,5 kg.
Ne pas utiliser en cas d’hypersensibilité à la substance active ou à l’un des excipients.
Mises en garde particulières à chaque espèce cible
Aucune.
Précautions particulières d'emploi
Précautions particulières pour une utilisation sûre chez les espèces cibles
Les maladies spécifiques (comme des maladies rénales par exemple) doivent être traitées de façon adaptée.
Une réduction du dosage doit être envisagée lorsque le chien est déjà traité pour une insuffisance cardiaque congestive ou pour une affection bronchique.
En cas d'insuffisance rénale, la dose doit être diminuée.
Précautions particulières à prendre par la personne qui administre le médicament
Eviter l'ingestion accidentelle du produit.
En cas d’ingestion accidentelle des comprimés, demander immédiatement conseil à un médecin et lui montrer la notice.
Se laver les mains après manipulation du produit.
Précautions particulières concernant la protection de l'environnement
Sans objet.
Autres précautions
Aucune.
Interactions médicamenteuses et autres formes d'interaction
Aucune connue.
Utilisation en cas de gravidité de lactation ou de ponte
L’innocuité du produit n’a pas été établie chez la chienne en gestation ou en lactation. Ne pas utiliser chez les chiennes en gestation ou en lactation, ou chez les animaux reproducteurs.
Effets indésirables
Chiens:
Rare (1 à 10 animaux / 10 000 animaux traités): | Des réactions allergiques cutanées*, des vomissements* ou des troubles cardiaques* |
* Si de tels cas se produisent, le traitement devra être interrompu.
Il est important de notifier les effets indésirables. La notification permet un suivi continu de l’innocuité d’un médicament vétérinaire. Les notifications doivent être envoyées, de préférence par l’intermédiaire d’un vétérinaire, soit au titulaire de l’autorisation de mise sur le marché ou à son représentant local, soit à l’autorité nationale compétente par l’intermédiaire du système national de notification. Voir également la rubrique 16 de la notice pour les coordonnées respectives.
Surdosage (symptômes, conduite d’urgences, antidotes)
Des phénomènes d'hyperexcitabilité, tachycardie, hypotension, congestion des muqueuses et vomissements ont été observés. Ces symptômes disparaissent spontanément après arrêt du traitement.
Antimicrobiens et antiparasitaires : lutte contre les résistances
Sans objet.
Informations pharmacologiques ou immunologiques
codes ATC
QC04AD90 : propentofylline
Pharmacodynamie
La propentofylline améliore l'irrigation sanguine, surtout celle du myocarde et des muscles.
Elle augmente également le flux sanguin ainsi que l'apport d'oxygène au niveau du cerveau, sans pour cela y augmenter le besoin en glucose. La propentofylline possède un effet chronotrope positif modéré et un effet inotrope positif marqué.
La propentofylline a également des effets antiarythmiques chez les chiens présentant une ischémie du myocarde ainsi qu'une activité bronchodilatatrice équivalente à celle de l'aminofylline.
La propentofylline améliore la déformabilité des érythrocytes et inhibe l'agrégation plaquettaire. Par son effet direct sur le coeur et sur la résistance périphérique des vaisseaux qu'elle réduit, la propentofylline diminue la charge cardiaque.
La propentofylline peut améliorer l'empressement à l'exercice et la tolérance à l'exercice, particulièrement chez le chien âgé.
Pharmacocinétique et environnement
Après administration orale, la propentofylline est absorbée rapidement et complètement. Elle se distribue rapidement dans les tissus. Chez le chien, le taux plasmatique maximal est obtenu 15 minutes après administration orale. La demi-vie est de 30 minutes environ et la biodisponibilité de la substance mère est d'environ 30 %. La biotransformation de la propentofylline s'effectue essentiellement dans le foie et il y a un certain nombre de métabolites actifs.
La propentofylline est excrétée sous forme de métabolites à 80 - 90 % par voie rénale, le reste étant éliminé par les matières fécales. Il n'y a pas d'accumulation.
Données pharmaceutiques
Incompatibilités majeures
Sans objet.
Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 5 ans.
Durée de conservation après ouverture
Durée de conservation des fractions de comprimés : 72 heures.
Précautions particulières de conservation selon pertinence
Conserver le produit dans son conditionnement primaire original (plaquette thermoformée). Conserver la plaquette thermoformée dans sa boîte en carton.
À conserver dans un endroit sec.
Tout comprimé entamé doit être conservé dans la plaquette thermoformée.
Précautions particulières à prendre lors de l'élimination de médicaments non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Utiliser les dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné.
Nature et composition du conditionnement primaire
Titulaire de l'autorisation de mise sur le marché
WIRTSCHAFTSGENOSSENSCHAFT DEUTSCHER TIERARZTE
SIEMENSSTRASSE 14 30827 GARBSEN Allemagne
Présentations commercialisées et AMM
| Présentation | GTIN | Numéro d'autorisation de mise sur le marché | Date de première mise sur le marché (ou AMM) | Classement du médicament en matière de délivrance | Accessible aux groupements |
|---|---|---|---|---|---|
| Boîte de 10 plaquettes thermoformées de 14 comprimés pelliculés quadrisécables | 3760087153668 | FR/V/8463495 9/2012 | 3/22/2012 | Soumis à prescription | Non |
| Boîte de 4 plaquettes thermoformées de 14 comprimés pelliculés quadrisécables | 3760087152142 | FR/V/8463495 9/2012 | 3/22/2012 | Soumis à prescription | Non |