
Composition
Principes actifs et excipients
Principes actifs
| Nom du principe actif | Quantité de principe actif |
|---|---|
| Tildipirosine | 40 mg |
Informations complémentaires
Un ml contient : Principe actif : Tildipirosine ................................ 40 mg
Clinique
Indications d'utilisation par espèce
- Porcins
Traitement et métaphylaxie des maladies respiratoires porcines (MRP) associées à Actinobacillus pleuropneumoniae, Pasteurella multocida, Bordetella bronchiseptica et Haemophilus parasuis sensibles à la tildipirosine. La présence de la pathologie dans le troupeau doit être établie avant de mettre en place une métaphylaxie.
Voie d'administration et posologie
Voie d'administration
- Intramusculaire
Posologie
- Porcins
Voie intramusculaire.
4 mg de tildipirosine par kg de poids vif (soit 1 ml pour 10 kg de poids vif), une seule fois.
Le volume administré ne doit pas excéder 5 ml par site d’injection.
Le bouchon caoutchouc du flacon peut être perforé jusqu’à 20 fois sans risque. Au-delà, l’utilisation d’une seringue multi-doses est recommandée.
Pour s’assurer d’un dosage correct, le poids de l’animal doit être déterminé aussi précisément que possible afin d’éviter un sous-dosage.
Il est recommandé de traiter les animaux en phase précoce de maladie et d’évaluer la réponse au traitement dans les 48 heures suivant l’injection.
Si les signes cliniques de pathologie respiratoire persistent ou augmentent, ou en cas de rechute, le traitement doit être changé en utilisant un autre antibiotique et poursuivi jusqu’à ce que les signes cliniques disparaissent.
Temps d'attente
Complément d'information temps d'attente
Viande et abats : 9 jours
Contre indications
Ne pas utiliser en cas d’hypersensibilité aux macrolides ou à l’un des excipients. Ne pas administrer par voie intraveineuse.
Mises en garde particulières à chaque espèce cible
En conformité avec les principes d’utilisation responsable, l’utilisation métaphylactique de Zuprevo n’est indiquée que dans le cas de graves épidémies de MRP dues aux agents pathogènes indiqués. La métaphylaxie implique que les animaux cliniquement sains, en contact avec des animaux malades, soient traités au même moment que les animaux cliniquement malades, afin de réduire le risque de développement de signes cliniques. L’efficacité de l’utilisation métaphylactique de Zuprevo a été démontrée dans une étude terrain contrôlée multi-centrique en comparaison avec un placebo, lorsque l’épidémie de la maladie clinique a été confirmée (à savoir, des animaux qui, dans au moins 30 % des cases, partageant le même espace, ont montré des signes cliniques de MRP, incluant au moins 10 % d’animaux par case en un jour ; ou 20 % dans les 2 jours ou 30 % dans les 3 jours). Suite à l’utilisation métaphylactique, environ 86 % des animaux en bonne santé sont demeurés indemnes de signes cliniques de la maladie (par rapport à environ 65 % des animaux dans le groupe témoin non traité).
Précautions particulières d'emploi
Précautions particulières pour une utilisation sûre chez les espèces cibles
L’utilisation du médicament doit être basée, autant que possible, sur des tests de sensibilité et prendre en compte les recommandations officielles nationales et régionales concernant l'antibiothérapie. Administration par voie intramusculaire stricte. Il faudra veiller particulièrement à utiliser le site d’injection approprié, ainsi qu’une aiguille de taille et de longueur appropriées (adaptée à la taille et au poids de l’animal), selon les bonnes pratiques vétérinaires.
Précautions particulières à prendre par la personne qui administre le médicament
Des études toxicologiques effectuées chez les animaux de laboratoire ayant montré des effets sur le système cardiovasculaire après administration intramusculaire de tildipirosine, une attention particulière est recommandée afin d’éviter toute auto-injection accidentelle. En cas d’auto-injection accidentelle, demandez immédiatement conseil à un médecin et montrez-lui la notice ou l’étiquetage. Ne pas administrer à l’aide de seringues automatiques dépourvues d’un système de protection complémentaire. La tildipirosine peut entraîner une sensibilisation par contact cutané. En cas d’exposition cutanée accidentelle, nettoyer immédiatement avec de l’eau et du savon. En cas d’exposition oculaire accidentelle, rincer immédiatement avec de l’eau propre.
Précautions particulières concernant la protection de l'environnement
Sans objet.
Autres précautions
Aucunes.
Interactions médicamenteuses et autres formes d'interaction
Il existe une résistance croisée avec d’autres macrolides. Ne pas administrer simultanément avec d’autres antibactériens ayant un mode d’action similaire, tels que les autres macrolides ou les lincosamides
Utilisation en cas de gravidité de lactation ou de ponte
L’innocuité du médicament vétérinaire n’a pas été établie en cas de gravidité ou de lactation. Toutefois, les études de laboratoire n’ont pas mis en évidence d’effets sélectifs sur le développement ou la reproduction. L’utilisation ne doit se faire qu’après une évaluation bénéfice-risque par le vétérinaire.
Effets indésirables
Dans de très rares cas, des réactions individuelles de choc potentiellement mortelles peuvent survenir. Dans de très rares cas, une léthargie transitoire a été observée chez les porcelets.
Lors des études d’innocuité menées chez l’espèce cible, l’administration de la dose maximale d’injection recommandée (5 ml) a provoqué occasionnellement de légers oedèmes au site d’injection, non douloureux à la palpation.
Les oedèmes ont persisté jusqu’à 3 jours. Les réactions anatomopathologiques au site d’injection ont disparu complètement dans les 21 jours.
Lors des essais cliniques, des douleurs à l’injection et des oedèmes au site d’injection, ont pu être observés très communément chez les porcs traités. Ces oedèmes ont disparu dans les 1 à 6 jours. La fréquence des effets indésirables possibles est définie selon la classification usuelle suivante :
● Très fréquent (effets indésirables chez plus d’1 animal sur 10 au cours d’un traitement)
● Fréquent (entre 1 et 10 animaux sur 100)
● Peu fréquent (entre 1 et 10 animaux sur 1.000)
● Rare (entre 1 et 10 animaux sur 10.000)
● Très rare (moins d’un animal sur 10.000, y compris les cas isolés).
Surdosage (symptômes, conduite d’urgences, antidotes)
Chez les porcelets, suite à l’administration par voie intramusculaire de la tildipirosine (à 3 reprises à 4 jours d’intervalle) à des doses de 8, 12 et 20 mg par kg de poids vif (PV) (2, 3 et 5 fois la dose recommandée), de légers signes transitoires de dépression ont été observés chez un porcelet de chacun des groupes à 8 et 12 mg par kg de poids vif, ainsi que chez 2 porcelets du groupe à 20 mg par kg de poids vif, après la première ou la seconde injection. Des tremblements musculaires aux pattes de derrière ont été observés après le premier traitement chez un porc de chacun des groupes à 12 et 20 mg par kg de poids vif. A la dose de 20 mg par kg de poids vif, un des 8 animaux a présenté des tremblements corporels transitoires avec incapacité à se tenir debout après la première administration ainsi qu’une instabilité transitoire sur ses pattes après la troisième administration. Un autre animal a présenté un choc en relation avec le traitement après la première administration et a dû être euthanasié pour éviter une souffrance animale. De la mortalité a été observée à des doses de 25 mg par kg de poids vif et plus.
Antimicrobiens et antiparasitaires : lutte contre les résistances
Sans objet.
Informations pharmacologiques ou immunologiques
codes ATC
QJ01FA96 : tildipirosine
Pharmacodynamie
La tildipirosine est un antibiotique de la classe des macrolides semi-synthétique à 16 atomes. Les trois groupes aminés situés sur l’anneau lactone confèrent un caractère tri-basique à la molécule.
Le produit a une longue durée d’action ; toutefois, la durée exacte de l’effet clinique après une seule injection n’est pas connue. 5 Les macrolides en général ont une activité bactériostatique mais aussi bactéricide sur certains pathogènes. Ils inhibent la biosynthèse des protéines essentielles grâce à leur liaison sélective à l’ARN du ribosome bactérien et en empêchant l’élongation de la chaîne peptidique. Ils ont généralement un effet temps-dépendant.
Le spectre de l’activité antibactérienne de la tildipirosine comprend : Actinobacillus pleuropneumoniae, Pasteurella multocida, Bordetella bronchiseptica et Haemophilus parasuis, qui sont les agents pathogènes les plus souvent associés à la maladie respiratoire porcine (MRP). In vitro, la tildipirosine a un effet bactériostatique sur Pasteurella multocida et B. bronchiseptica, et bactéricide sur A. pleuropneumoniae et H. parasuis. Les Concentrations Minimales Inhibitrices (CMI) issues des pathogènes cibles (distribution type sauvage) sont présentées dans le tableau ci-dessous :
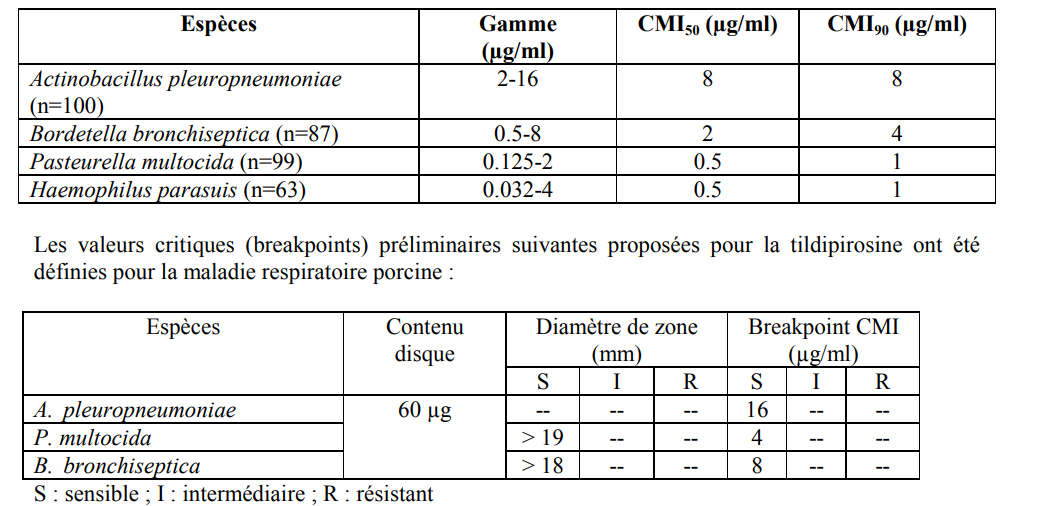
La résistance aux macrolides résulte généralement de trois mécanismes : (1) altération du site cible du ribosome (methylation), souvent nommée résistance aux MLSB étant donné qu’elle affecte les macrolides, les lincosamides et les streptogramines de groupe B, (2) l’utilisation du mécanisme d’efflux actif, (3) la production d’enzymes inactivantes. En général, il faut s’attendre à une résistance croisée entre la tildipirosine et les autres macrolides, les lincosamides ou les streptogramines.
Des données ont été recueillies sur les bactéries zoonotiques et les commensaux. Les CMI pour Salmonella se situaient entre 4 et 16 µg/ml, et toutes les souches enregistrées étaient de type sauvage. Pour E. coli, Campylobacter et Enterococci (CMI entre 1 et > 64 µg/ml), les deux phénotypes, sauvage et non sauvage, ont été enregistrés.
Pharmacocinétique et environnement
Chez les porcs, la tildipirosine administrée par voie intramusculaire à une dose unique de 4 mg/kg de poids vif, a été rapidement absorbée avec un pic de concentration plasmatique de 0.9 µg/ml atteint en 23 minutes (Tmax).
Les macrolides se caractérisent par leur large distribution dans les tissus. L’accumulation au site d’infection du tractus respiratoire est démontrée par une concentration de la tildipirosine bien plus élevée et durable dans les poumons et le fluide bronchique (recueillis post mortem) que dans le plasma sanguin. La demi-vie moyenne d’élimination est de 4,4 jours. In vitro, la liaison de la tildipirosine aux protéines plasmatiques porcines est limitée approximativement à 30 %. Chez les porcs, il est admis que le métabolisme de la tildipirosine s’opère 6 par réduction et conjugaison sulfate suivies d’une hydratation (ou ouverture de l’anneau), par déméthylation, par di-hydroxylation et par conjugaison S-cystéine et S-glutathione.
Sur une période de 14 jours, l’excrétion totale moyenne de la dose complète administrée était d’environ 17 % dans les urines et 57 % dans les fèces
Données pharmaceutiques
Incompatibilités majeures
En l’absence d’études de compatibilité, ce médicament vétérinaire ne doit pas être mélangé avec d’autres médicaments vétérinaires.
Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 2 ans.
Durée de conservation après ouverture
Durée de conservation après première ouverture du conditionnement primaire : 28 jours.
Température de conservation
Ne pas conserver à une température supérieure à 25°C.
Précautions particulières à prendre lors de l'élimination de médicaments non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Tous médicaments vétérinaires non utilisés ou déchets dérivés de ces médicaments doivent être éliminés conformément aux exigences locales.
Nature et composition du conditionnement primaire
Flacon verre type I, bouchon caoutchouc chlorobutyle et capsule en aluminium. Boîte contenant 1 flacon de 20 ml, 50 ml, 100 ml ou 250 ml. Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l'autorisation de mise sur le marché
Présentations commercialisées et AMM
| Présentation | GTIN | Numéro d'autorisation de mise sur le marché | Date de première mise sur le marché (ou AMM) | Classement du médicament en matière de délivrance | Accessible aux groupements |
|---|---|---|---|---|---|
| Boîte de 1 flacon de 250 ml | 08713184112408 | EU/2/11/124/004 | Non | ||
| Boîte de 1 flacon de 100 ml | 08713184111302 | EU/2/11/124/003 | Soumis à prescription | Non |
