MODULIS® 100 mg/mL SOLUTION BUVABLE POUR CHIENS
Identification
- Dénomination du médicament vétérinaire
- MODULIS® 100 mg/mL SOLUTION BUVABLE POUR CHIENS
- Forme pharmaceutique
- Solution buvable
Composition
- Principes actifs
Nom du principe actif Quantité de principe actif Ciclosporine 100 mg - Excipients
Nom de l'excipient Quantité de l'excipient Tout-rac-alpha-tocophérol (E307) 1 mg - Informations supplémentaires
Composition qualitative en excipients et autres composants Composition quantitative si cette information est essentielle à une bonne administration du médicament vétérinaire Tout-rac-alpha-tocophérol (E307) 1 mg Ethanol anhydre (E1510) Propylèneglycol (E1520) Hydroxystéarate de macrogolglycérol Monolinoléate de glycérol Solution claire à légèrement jaune. Un voile, de légers flocons ou un léger dépôt peuvent être observés.
Usage clinique
Indications d'utilisation par espèce
| Espèce(s) | Utilisation |
|---|---|
| Traitement des manifestations chroniques de la dermatite atopique chez les chiens. |
- Contre-indications
Ne pas utiliser en cas d'hypersensibilité à la ciclosporine ou à l'un des excipients.
Ne pas utiliser chez les chiens âgés de moins de 6 mois ou pesant moins de 2 kg.
Ne pas utiliser en cas d'antécédents d'affections malignes ou d'affections malignes évolutives.
Ne pas vacciner avec un vaccin vivant pendant le traitement ou pendant un intervalle de deux semaines avant ou après le traitement (voir les rubriques « Précautions particulières d'emploi » et « Interactions médicamenteuses et autres formes d'interactions »).
Précautions et mises en garde
- Mise en garde particulière à chaque espèce cible
Il convient d’envisager d’autres mesures et/ou traitements pour contrôler tout prurit modéré à sévère au moment d’instaurer le traitement par la ciclosporine.
- Précautions particulières pour une utilisation sûre chez les espèces cibles
Les signes cliniques de la dermatite atopique tels que le prurit et l'inflammation cutanée ne sont pas spécifiques à cette maladie; de ce fait les autres causes de dermatite comme les infestations d'ectoparasites, les autres allergies responsables de signes dermatologiques (allergie aux puces ou allergie alimentaire) ainsi que les infections bactériennes et fongiques doivent être écartées avant de démarrer le traitement. Il est souhaitable de traiter l'infestation des puces avant et pendant le traitement de la dermatite atopique.
Il est également recommandé d'éliminer toute infection bactérienne et fongique avant d'administrer le médicament. Par contre, l'apparition d'une infection en cours de traitement ne nécessite pas obligatoirement l'arrêt de ce dernier sauf si l'infection est sévère.
Un examen clinique complet doit être réalisé avant le traitement. Comme la ciclosporine n'inhibe pas les lymphocytes T et bien qu'elle n'induise pas de tumeurs, elle pourrait conduire à l'augmentation de l'incidence des manifestations cliniques d'affections malignes, en raison de la diminution de la réponse immunitaire antitumorale. Toute lymphadénopathie observée en cours de traitement à la ciclosporine doit être régulièrement contrôlée.
Chez les animaux de laboratoire, la ciclosporine est susceptible d'affecter les taux circulants d'insuline et d'entraîner une augmentation de la glycémie. En présence de signes évocateurs de diabète sucré, l'effet du traitement sur la glycémie devra donc être surveillé. En cas d'apparition de diabète après traitement avec la spécialité (ex : polyurie ou polydipsie), la posologie doit être diminuée ou le traitement arrêté et un vétérinaire doit être consulté.
L'utilisation du médicament vétérinaire n'est pas recommandée chez les chiens diabétiques.
Surveiller la créatininémie chez les chiens présentant une insuffisance rénale sévère.
La vaccination doit faire l'objet d'une attention particulière. Le traitement avec le médicament peut modifier l'efficacité des vaccins. En cas de vaccins inactivés, il n'est pas recommandé de vacciner pendant le traitement ou dans l'intervalle de deux semaines avant ou après l’administration du médicament vétérinaire. Pour les vaccins vivants, voir la rubrique 3.3 « Contre-indications ».
Il n'est pas recommandé de traiter, de façon concomitante, avec un autre immunosuppresseur.
- Précaution particulière à prendre par la personne qui administre le médicament
Une ingestion accidentelle de ce produit peut provoquer des nausées et / ou des vomissements. Pour éviter toute ingestion accidentelle, le produit doit être utilisé et maintenu hors de la portée des enfants. Ne laissez pas de seringue remplie sans surveillance en présence d'enfants. En cas d'ingestion accidentelle, en particulier par un enfant, demandez immédiatement conseil à un médecin et montrez-lui la notice ou l'étiquette.
La ciclosporine peut déclencher des réactions d'hypersensibilité (allergiques). Les personnes présentant une hypersensibilité connue à la ciclosporine doivent éviter tout contact avec le produit.
Une irritation des yeux est peu probable. Par mesure de précaution, évitez le contact avec les yeux. En cas de contact, rincer abondamment à l'eau claire. Se laver les mains et toute peau exposée après utilisation.
- Précautions particulières concernant la protection de l'environnement
Sans objet.
- Autres précautions
Aucune.
Interactions et cas particuliers
- Utilisation en cas de gravidité, de lactation ou de ponte
Gestation et lactation :
Chez les animaux de laboratoire, aux doses induisant une materno-toxicité (rats à 30 mg/kg de poids corporel et lapins à 100 mg/kg de poids corporel), la ciclosporine est embryo- et fœtotoxique, par augmentation de la mortalité pré- et postnatale et induit un retard staturo-pondéral du fœtus.
Aux doses bien tolérées (rats jusqu'à 17 mg/kg de poids corporel et lapins jusqu'à 30 mg/kg de poids corporel) la ciclosporine n'a pas montré d'effet tératogène ni d'effet sur la reproduction.
L'innocuité de la spécialité n'a pas été évaluée chez les chiens mâles reproducteurs ni chez les femelles gestantes ou allaitantes. En l'absence d'études chez le chien, il est recommandé de n'utiliser la spécialité qu'après évaluation du rapport bénéfice/risque par un vétérinaire.
La ciclosporine passe la barrière placentaire et est excrétée dans le lait. Par conséquent, le traitement des chiennes allaitantes n'est pas recommandé.
- Interactions médicamenteuses et autres formes d'interactions
Diverses substances peuvent inhiber ou stimuler de façon compétitive les enzymes qui interviennent dans le métabolisme de la ciclosporine, en particulier le cytochrome P450 (CYP 3A 4). Dans certains cas cliniquement justifiés, un ajustement de la posologie de la spécialité peut être nécessaire. Le kétoconazole à la dose de 5-10 mg/kg augmente les concentrations sanguines de ciclosporine jusqu'à cinq fois chez le chien, ce qui peut être cliniquement significatif. Lors de l'utilisation concomitante de kétaconazole et de ciclosporine, le vétérinaire doit envisager la possibilité de doubler l'intervalle de traitement si le chien suit un traitement journalier.
Les macrolides peuvent augmenter les concentrations plasmatiques de ciclosporine jusqu'à deux fois.
Certains inducteurs du cytochrome P450, anticonvulsivants et antibiotiques (par exemple : triméthoprime/sulfadimidine) peuvent diminuer la concentration plasmatique de la ciclosporine.
La ciclosporine est un substrat et un inhibiteur de la P-glycoprotéine de transport MDR1. Par conséquent, la co-administration de ciclosporine avec des substrats de P-glycoprotéine tels que les lactones macrocycliques (par exemple : ivermectine et milbémycine) peut diminuer l'efflux de ces molécules des cellules de la barrière hémato-encéphalique, pouvant provoquer des signes de toxicité du système nerveux central.
La ciclosporine peut augmenter la néphrotoxicité des antibiotiques de la famille des aminoglycosides et du triméthoprime.
L'administration concomitante de la ciclosporine n'est pas recommandée avec ces substances actives.
La vaccination doit faire l'objet d'une attention particulière (voir rubriques 3.3 « Contre-indications » et 3.5 « Précautions particulières d'emploi »). En cas d'utilisation concomitante d'agents immunosuppresseurs : voir la rubrique 3.5 « Précautions particulières d'emploi ».
- Anti-microbiens et anti-parasitaires : lutte contre les résistances
Sans objet.
Effets indésirables et surdosage
- Incompatibilité majeure
En l'absence d'études de compatibilité, ce médicament vétérinaire ne doit pas être mélangé avec d'autres médicaments vétérinaires.
- Effets indésirables
Chiens.
Fréquent
(1 à 10 animaux / 100 animaux traités) :
Selle mucoïde1, selle molle1 Peu fréquent
(1 à 10 animaux / 1 000 animaux traités) :
Hyperactivité1,
Lésion cutanée1 (par ex. papillome cutané ou modification du pelage)
Faiblesse musculaire1, crampe musculosquelettique1
Rare
(1 à 10 animaux / 10 000 animaux traités) :
Vomissement2 Très rare
( < 1 animal / 10 000 animaux traités, y compris les cas isolés) :
Diarrhée, hyperplasie gingivale2
Léthargie2, anorexie2
Irritation du pavillon2
Diabète3
1 ces effets disparaissent spontanément après l'arrêt du traitement
2 ces effets sont bénins et transitoires et ne nécessitent généralement pas l'arrêt du traitement.
3 principalement chez le West Highland White Terrier
Posologie
| Espèce(s) | Posologie |
|---|---|
| Voie orale. Avant de débuter le traitement, il conviendra d’évaluer toutes les autres options thérapeutiques disponibles. La dose moyenne recommandée est de 5 mg de ciclosporine par kg de poids corporel soit 0,5 mL pour 10 kg de poids corporel.
Des traitements d'appoint (par exemple : shampooings médicamenteux, acides gras essentiels) peuvent être envisagés avant de réduire l'intervalle posologique. Les animaux doivent être régulièrement réexaminés et d’autres options thérapeutiques devront être prises en considération. Le traitement peut être arrêté quand les signes cliniques sont contrôlés. En cas de récidive de ces signes, le traitement doit être repris à doses quotidiennes, et dans certains cas des cures répétées peuvent être nécessaires. Le médicament doit être donné au moins 2 heures avant ou après le repas. Le médicament doit être donné directement dans la gueule de l’animal.
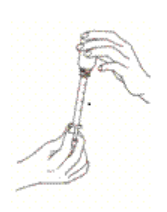
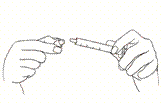
Tenir le flacon à l’envers et tirer lentement sur le piston de la seringue jusqu’à ce que la ligne blanche du piston corresponde à la dose prescrite par votre vétérinaire. La seringue est graduée en kg et en mL. Fermer le flacon et placer le capuchon approprié sur l’embout de la seringue afin d’éviter toute contamination ou débordement de produit restant.
Pour assurer un dosage correct, le poids corporel doit être déterminée aussi précisèment que possible.
|
Temps d'attente
- Voie d'administration
- Orale
| Espèce(s) | Denrée | Temps d'attente |
|---|---|---|
|
| 0 Sans objet |
Conservation et stockage
- Température de conservation
La conservation au réfrigérateur doit être évitée. Le produit contient des composants graisseux d'origine naturelle qui peuvent se solidifier sous des températures plus basses. En dessous de 20°C, il peut se former une gelée pouvant toutefois redevenir liquide lorsque la température atteint un maximum de 30°C. De légers flocons ou un léger dépôt peuvent toujours être observés. Cependant, cela n'affecte ni la posologie, ni l'efficacité ou la sécurité d'emploi du produit.
- Précautions particulières de conservation selon pertinence
A conserver dans le carton d'origine.
La conservation au réfrigérateur doit être évitée. Le produit contient des composants graisseux d'origine naturelle qui peuvent se solidifier sous des températures plus basses. En dessous de 20°C, il peut se former une gelée pouvant toutefois redevenir liquide lorsque la température atteint un maximum de 30°C. De légers flocons ou un léger dépôt peuvent toujours être observés. Cependant, cela n'affecte ni la posologie, ni l'efficacité ou la sécurité d'emploi du produit.
- Précaution particulière à prendre lors de l'élimination
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Utiliser les dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné.
Informations commerciales
| Présentation | Accessible au groupement | Classement du médicament en matière de délivrance | Numéro d'autorisation de mise sur le marché |
|---|---|---|---|
| Boîte de 1 flacon de 30 mL et de 1 seringue pour administration orale de 2 mL graduée tous les 0,1 mL | Non | Soumis à prescription | FR/V/0321650 5/2014 |
| Boîte de 1 flacon de 50 mL et de 1 seringue pour administration orale de 2 mL graduée tous les 0,1 mL | Non | Soumis à prescription | FR/V/0321650 5/2014 |
| Boîte de 1 flacon de 5 mL et de 1 seringue pour administration orale de 1 mL graduée tous les 0,05 mL | Non | Soumis à prescription | FR/V/0321650 5/2014 |
| Boîte de 1 flacon de 15 mL et de 1 seringue pour administration orale de 1 mL graduée tous les 0,05 mL | Non | Soumis à prescription | FR/V/0321650 5/2014 |
Informations de révision
- Date de révision de la notice
- 1/1/1970
Responsabilités
- Titulaire de l'autorisation de mise sur le marché
- CEVA SANTE ANIMALE
- 8 rue de Logrono
33500 LIBOURNEhttp://www.ceva.com
- Responsable de la mise sur le marché
- CEVA SANTE ANIMALE
- 8 rue de Logrono
33500 LIBOURNEhttp://www.ceva.com
- Responsable de la pharmacovigilance
- CEVA SANTE ANIMALE
- 8 rue de Logrono
33500 LIBOURNEhttp://www.ceva.com