FLUOXEVET 32 MG, COMPRIMES POUR CHIENS
Identification
- Dénomination du médicament vétérinaire
- FLUOXEVET 32 MG, COMPRIMES POUR CHIENS
- Forme pharmaceutique
- Comprimé
Composition
- Principes actifs
Nom du principe actif Quantité de principe actif Fluoxétine (sous forme de chlorhydrate) 32 mg/comprimé - Excipients
Nom de l'excipient Cellulose microcristalline silicifiée Calcium hydrogénophosphate dihydraté Arôme bœuf Sucralose Silice colloïdale anhydre Talc Stéarate de magnésium Arôme masquant - Informations supplémentaires
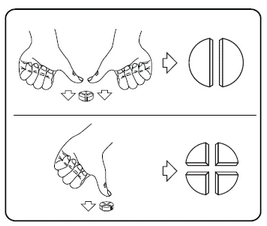
Comprimé blanc à crème, tacheté, rond et convexe, portant une barre de sécabilité en forme de croix.
Les comprimés peuvent être divisés en 2 ou 4 parties égales.
Chaque comprimé contient :
Substance active :
Fluoxétine 32,0 mg (équivalant à 35,80 mg de chlorhydrate de fluoxétine)
Usage clinique
Indications d'utilisation par espèce
| Espèce(s) | Utilisation |
|---|---|
| Aide au traitement des troubles du chien lié à la séparation, qui se manifestent par des comportements de destruction et inappropriés (vocalisation et défécation et/ou miction incontrôlées), et uniquement en association avec des techniques de modification du comportement. |
- Contre-indications
Ne pas utiliser chez les chiens pesant moins de 4 kg.
Ne pas utiliser chez les chiens épileptiques ou ayant des antécédents de convulsions.
Ne pas utiliser en cas d’hypersensibilité à la substance active ou d’autres inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) ou à l’un des excipients.
Précautions et mises en garde
- Mise en garde particulière à chaque espèce cible
Aucune.
- Précautions particulières pour une utilisation sûre chez les espèces cibles
L’innocuité du médicament vétérinaire n’a pas été établie chez les chiens âgés de moins de 6 mois ou pesant moins de 4 kg.
Les comprimés sont aromatisés. Afin d’éviter toute ingestion accidentelle, conserver les comprimés hors de portée des animaux.
Bien que rares, des convulsions peuvent se produire chez les chiens traités avec le médicament vétérinaire. Le traitement doit être arrêté en cas de convulsions.
- Précaution particulière à prendre par la personne qui administre le médicament
Chez l’Homme, les symptômes les plus habituels associés à un surdosage sont des convulsions, une somnolence, des nausées, une tachycardie et des vomissements.
Afin d’éviter toute ingestion accidentelle, notamment chez l’enfant, remettre immédiatement les fractions de comprimé inutilisées dans le flacon, puis replacer le système de fermeture sécurité-enfant et conserver le produit hors de la vue et de la portée des enfants. Tout aliment médicamenteux non consommé doit être jeté immédiatement et le bol doit être lavé soigneusement.
En cas d’ingestion accidentelle, demandez immédiatement conseil à un médecin et montrez-lui la notice ou l’étiquette.
Un risque de malformations congénitales a été observé chez les nourrissons dont la mère a été exposée à la fluoxétine en début de grossesse. Les femmes enceintes devraient éviter un contact cutané prolongé avec le produit.
La substance active fluoxétine peut causer une irritation oculaire. Il convient donc d'éviter tout contact entre les mains et les yeux. En cas de contact accidentel avec les yeux, rincer immédiatement et abondamment à l'eau.
Se laver les mains après utilisation.
- Précautions particulières concernant la protection de l'environnement
Sans objet.
- Autres précautions
Sans objet.
Interactions et cas particuliers
- Utilisation en cas de gravidité, de lactation ou de ponte
Les études de laboratoire sur les rats et les lapins n’ont pas mis en évidence d’effets tératogènes, foetotoxiques ou maternotoxiques. Aucun effet sur la capacité reproductrice des rats mâles et femelles n’a été constaté.
Gestation et lactation :
L’innocuité du médicament vétérinaire n’a pas été établie en cas de gestation et lactation.
Utilisation non recommandée durant la gestation et la lactation.
Fertilité :
Ne pas utiliser sur les animaux destinés à la reproduction.
- Interactions médicamenteuses et autres formes d'interactions
Le médicament vétérinaire ne doit pas être donné de façon concomitante avec des médicaments vétérinaires qui abaissent le seuil d’apparition des convulsions (par exemple, les phénothiazines telles que l’acépromazine ou la chlorpromazine).
Ne pas utiliser le médicament vétérinaire avec d’autres agents sérotonergiques (par exemple, la sertraline) et des inhibiteurs de la monoamine oxydase (MAOI) (par exemple, l’hydrochlorure de sélégiline (L-déprényl), amitraz) ou des amines tricycliques (TCA) (par exemple, l’amitriptyline et la clomipramine).
Un intervalle libre de 6 semaines doit être observé suite à l’interruption du traitement par le médicament vétérinaire avant l’administration d’un médicament vétérinaire susceptible d’interagir de façon négative avec la fluoxétine ou son métabolite, la norfluoxétine.
La fluoxétine est en grande partie métabolisée par le système enzymatique P-450, bien que l’isoforme précise chez les chiens demeure inconnue. La fluoxétine doit par conséquent être utilisée avec prudence en association avec d’autres médicaments vétérinaires.
Effets indésirables et surdosage
- Incompatibilité majeure
Sans objet.
- Effets indésirables
Chiens :
Très fréquent
(> 1 animal / 10 animaux traités) :
Diminution de l’appétit ou perte d’appétit, léthargie Fréquent
(1 à 10 animaux / 100 animaux traités) :
Cystite, incontinence urinaire, rétention urinaire, strangurie
Incoordination, désorientation
Peu fréquent
(1 à 10 animaux / 1 000 animaux traités) :
Perte de poids / perte d’état
Mydriase
Rare
(1 à 10 animaux / 10 000 animaux traités) :
Halètement
Convulsions
Vomissements
Il est important de notifier les effets indésirables. La notification permet un suivi continu de l’innocuité d’un médicament vétérinaire. Les notifications doivent être envoyées, de préférence par l’intermédiaire d’un vétérinaire, soit au titulaire de l’autorisation de mise sur le marché ou à son représentant local, soit à l’autorité nationale compétente par l’intermédiaire du système national de notification. Voir également la rubrique « Coordonnées » de la notice.
Posologie
| Espèce(s) | Posologie |
|---|---|
| Le médicament vétérinaire doit être administré par voie orale à la dose quotidienne unique de 1 à 2 mg/kg de poids corporel.
Les comprimés peuvent être divisés en 2 ou 4 parties égales pour assurer le dosage précis. Placer le comprimé sur une surface plane, la face portant la barre de sécabilité étant tournée vers le haut et la face convexe (arrondie) vers la surface.
Une amélioration clinique devrait se produire avec le médicament vétérinaire après 1 à 2 semaines. Si aucune amélioration n’est constatée dans les 4 semaines, consulter votre vétérinaire afin qu’il réévalue le cas. Des études cliniques ont montré qu’une réponse bénéfique avait été démontrée avec un traitement jusqu’à 8 semaines avec la fluoxétine.
Les comprimés peuvent être administrés avec ou sans nourriture.
En cas d’oubli d’une dose, la dose programmée suivante doit être administrée comme cela a été prescrit. À la fin du traitement, il n’est pas nécessaire de diminuer ou de réduire les doses compte tenu de la longue demi-vie du médicament vétérinaire. |
Temps d'attente
- Voie d'administration
- Orale
Conservation et stockage
- Température de conservation
- Non renseigné
- Précautions particulières de conservation selon pertinence
À conserver dans l’emballage d’origine.
Les fractions de comprimés doivent être replacées dans le flacon et le flacon dans la boîte. Utiliser les fractions restantes lors des prochaines administrations.
- Précaution particulière à prendre lors de l'élimination
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Utiliser les dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné.
Informations commerciales
| Présentation | Accessible au groupement | Classement du médicament en matière de délivrance | Numéro d'autorisation de mise sur le marché |
|---|---|---|---|
| FLUOXEVET Boîte de 1 flacon de 30 comprimés | Non | Soumis à prescription | FR/V/7573797 1/2024 |
Informations de révision
- Date de révision de la notice
- 9/20/2024
Responsabilités
- Titulaire de l'autorisation de mise sur le marché
- DÔMES PHARMA
- Z.A.C. de Champ Lamet 3 rue André Citroën 63430 PONT-DU-CHÂTEAU
http://www.domespharma.com
- Responsable de la mise sur le marché
- DÔMES PHARMA FR - Gamme vétérinaire
- DÔMES PHARMA FR - Division Vétérinaire -57 rue des Bardines 63370 LEMPDES
https://www.domespharma.fr/
- Responsable de la pharmacovigilance
- DÔMES PHARMA FR - Gamme vétérinaire
- DÔMES PHARMA FR - Division Vétérinaire -57 rue des Bardines 63370 LEMPDES
https://www.domespharma.fr/