BIOCEFAVET 75 MG COMPRIMES A CROQUER POUR CHIENS ET CHATS
Identification
- Dénomination du médicament vétérinaire
- BIOCEFAVET 75 MG COMPRIMES A CROQUER POUR CHIENS ET CHATS
- Forme pharmaceutique
- Comprimé à croquer
Composition
- Principes actifs
Nom du principe actif Quantité de principe actif Céfalexine (sous forme de monohydrate) 75 mg - Excipients
Nom de l'excipient Cellulose microcristalline Povidone K30 Carboxyméthylamidon sodique (type A) Amidon de maïs Arôme viande Stéarate de magnésium - Informations supplémentaires
Comprimé rond et convexe blanc cassé à brun clair avec des taches brunes et une barre de sécabilité en croix d’un côté. Les comprimés peuvent être divisés en 2 ou 4 parties égales. Le comprimé a un diamètre d’environ 7 mm.
Usage clinique
Indications d'utilisation par espèce
| Espèce(s) | Utilisation |
|---|---|
| Pour le traitement des : - infections du tractus urinaire causées par Escherichia coli, Proteus mirabilis et Staphylococcus aureus ; - infections cutanées causées par Staphylococcus spp ; - infections des voies respiratoires causées par Pasteurella multocida. |
- Contre-indications
Ne pas utiliser en cas d’hypersensibilité à la substance active, à d’autres céphalosporines, à d’autres substances du groupe des β-lactamines ou à l’un des excipients.
Ne pas utiliser chez les lapins, les cobayes, les hamsters et les gerbilles.
Précautions et mises en garde
- Mise en garde particulière à chaque espèce cible
Ne pas utiliser en cas de résistance connue aux céphalosporines ou aux pénicillines.
Une résistance croisée a été démontrée entre la céfalexine et d’autres antibiotiques du groupe des bêtalactamines. L’utilisation du produit doit être soigneusement étudiée lorsque les tests de sensibilité ont montré une résistance aux bêtalactamines car dans ce cas son efficacité pourrait être diminuée.
- Précautions particulières pour une utilisation sûre chez les espèces cibles
L’utilisation du médicament vétérinaire doit être basée sur l’identification et la réalisation de tests de sensibilité du / des pathogène(s) cibles(s). Si cela n’est pas possible, le traitement doit s’appuyer sur des informations épidémiologiques et la connaissance de la sensibilité des agents pathogènes cibles au niveau de l’exploitation ou au niveau locale/régionale. L’utilisation du médicament vétérinaire doit être conforme aux politiques officielles, nationales et régionales en matière antimicrobiens.
Comme pour les autres antibiotiques qui sont éliminés essentiellement par voie rénale, une accumulation systémique excessive peut se produire en cas d’altérations de la fonction rénale. En cas d’insuffisance rénale connue, la posologie doit être réduite ou l’intervalle d’administration doit être augmenté. Les antimicrobiens ayant un effet néphrotoxiques connu ne doivent pas être administrés de façon concomitante et l’utilisation du produit devra faire l’objet d’une évaluation du rapport bénéfice/risque réalisée par le vétérinaire responsable.
Les comprimés sont aromatisés. Afin d’éviter toute ingestion accidentelle, conserver les comprimés hors de portée des animaux.
Un antibiotique présentant un risque plus faible d’antibiorésistance (catégorie AMEG inférieure) doit être utilisé pour le traitement initial lorsque le test de sensibilité suggère l’efficacité probable de cette approche.
- Précaution particulière à prendre par la personne qui administre le médicament
Les pénicillines et les céphalosporines peuvent provoquer des réactions d’hypersensibilité (allergie) après une injection, une inhalation, une ingestion ou un contact cutané. L’hypersensibilité aux pénicillines peut entraîner une réaction croisée avec les céphalosporines et inversement. Les réactions allergiques à ces substances peuvent être occasionnellement graves.
Les personnes présentant une hypersensibilité connue aux pénicillines et aux céphalosporines doivent éviter tout contact avec le médicament vétérinaire.
En cas d'apparition de symptômes, tels qu’une éruption cutanée, suite à l’exposition au produit, consulter un médecin et lui montrer cette mise en garde. Un œdème du visage, des lèvres ou des yeux, ou des difficultés respiratoires, sont des symptômes plus graves qui nécessitent une consultation médicale d'urgence. Se laver les mains après utilisation.
Ce médicament vétérinaire peut être nocif en cas d’ingestion accidentelle.
Pour éviter toute ingestion accidentelle, en particulier chez l’enfant, les comprimés partiellement utilisés doivent être remis dans l’alvéole ouverte de la plaquette, qui doit être remise dans l’emballage extérieur et conservés en lieu sûr, hors de la vue et de la portée des enfants.
En cas d’ingestion accidentelle, consulter immédiatement un médecin et montrez-lui la notice ou l’étiquette.
- Précautions particulières concernant la protection de l'environnement
Sans objet.
- Autres précautions
Sans objet.
Interactions et cas particuliers
- Utilisation en cas de gravidité, de lactation ou de ponte
L’innocuité du médicament vétérinaire n’a pas été établie chez les chats et les chiens en cas de gestation et de lactation.
Gestation et lactation :
Les études de laboratoire sur les rats et les souris n’ont pas mis en évidence d’effets tératogènes.
L’utilisation ne doit se faire qu’après évaluation du rapport bénéfice/risque établie par le vétérinaire responsable.
- Interactions médicamenteuses et autres formes d'interactions
Pour garantir l’efficacité, le médicament vétérinaire ne doit pas être utilisé en association avec des antibiotiques bactériostatiques (macrolides, sulfonamides et tétracyclines). L’utilisation concomitante de céphalosporines de première génération avec des antibiotiques de type aminoglycoside ou certains diurétiques tels que le furosémide peut augmenter les risques de néphrotoxicité.
- Anti-microbiens et anti-parasitaires : lutte contre les résistances
Sans objet.
Effets indésirables et surdosage
- Incompatibilité majeure
Sans objet.
- Effets indésirables
Chats et chiens :
Rare
(1 à 10 animaux / 10 000 animaux traités) :
Réaction d’hypersensibilité* Très rare
( < 1 animal / 10 000 animaux traités, y compris les cas isolés ):
Léthargie Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) : Vomissements, nausée, diarrhée *en cas de réaction d’hypersensibilité, le traitement doit être interrompu.
Il est important de notifier les effets indésirables. La notification permet un suivi continu de l’innocuité d’un médicament vétérinaire. Les notifications doivent être envoyées, de préférence par l’intermédiaire d’un vétérinaire, soit au titulaire de l’autorisation de mise sur le marché ou à son représentant local, soit à l’autorité nationale compétente par l’intermédiaire du système national de notification. Voir également la notice pour les coordonnées respectives.
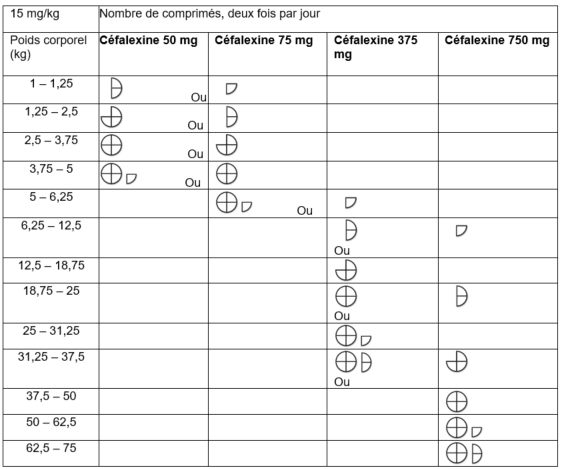
Posologie
| Espèce(s) | Posologie |
|---|---|
| Voie orale.
15 mg de céfalexine par kg de poids corporel, deux fois par jour, pendant 5 jours consécutifs. Un cycle de traitement prolongé pourra être prescrit par le vétérinaire responsable. Dans les cas sévères ou aigus, la dose peut être doublée, uniquement après évaluation du rapport bénéfice/risque établie par le vétérinaire responsable.
Pour s’assurer d’un dosage correct, le poids corporel doit être déterminé aussi précisément que possible.
Le tableau suivant est destiné à servir de guide pour l’administration du médicament vétérinaire à une dose de 15 mg de céfalexine par kilo de poids corporel, deux fois par jour.
Grâce à la barre de sécabilité en croix, les comprimés peuvent être divisés en deux parties égales (37,5 mg de céfalexine) ou en quatre parties égales (18,75 mg de céfalexine). Les comprimés divisés doivent être utilisés lors de l’administration suivante. Placez le comprimé sur une surface plate avec la croix vers le haut : - Moitiés : pressez les deux côtés du comprimé avec les pouces. - Quarts : pressez le centre du comprimé avec le pouce. |
Temps d'attente
- Voie d'administration
- Orale
Conservation et stockage
- Température de conservation
À conserver à une température ne dépassant pas 30º C.
- Précautions particulières de conservation selon pertinence
- Non renseigné
- Précaution particulière à prendre lors de l'élimination
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Utiliser les dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné.
Informations commerciales
| Présentation | Accessible au groupement | Classement du médicament en matière de délivrance | Numéro d'autorisation de mise sur le marché |
|---|---|---|---|
| Boîte en carton contenant 10 plaquettes de 10 comprimés | Non | Soumis à prescription | FR/V/3032020 2/2024 |
Informations de révision
- Date de révision de la notice
- 1/1/1970
Responsabilités
- Titulaire de l'autorisation de mise sur le marché
- AXIENCE S.A.S.
- Tour Essor
14, rue Scandicci
93500 PANTINhttp://www.axience.fr
- Responsable de la mise sur le marché
- AXIENCE S.A.S.
- Tour Essor
14, rue Scandicci
93500 PANTINhttp://www.axience.fr
- Responsable de la pharmacovigilance
- AXIENCE S.A.S.
- Tour Essor
14, rue Scandicci
93500 PANTINhttp://www.axience.fr