NAXCEL® 200 mg/mL Suspension injectable pour bovins
Identification
- Dénomination du médicament vétérinaire
- NAXCEL® 200 mg/mL Suspension injectable pour bovins
- Forme pharmaceutique
- Suspension injectable
Composition
- Principes actifs
- Ceftiofur (sous forme d’acide libre cristallin)
- Excipients
- Triglycérides à chaîne moyenne
- Huile de coton
- Informations supplémentaires
Suspension opaque de couleur blanche à marron clair.
Usage clinique
Indications d'utilisation par espèce
| Espèce(s) | Utilisation |
|---|---|
| Chez les bovins, traitement curatif de la nécrobacillose interdigitée aiguë également appelée panaritium ou panaris interdigité. |
- Contre-indications
Ne pas utiliser en cas d’hypersensibilité à la substance active, à d’autres bêta-lactamines ou à l’un des excipients.
Précautions et mises en garde
- Mise en garde particulière à chaque espèce cible
Aucune.
- Précautions particulières pour une utilisation sûre chez les espèces cibles
Les céphalosporines à large spectre administrées par voie systémique (3ème et 4ème générations, dont le ceftiofur) doivent être réservées au traitement de situations cliniques qui ont répondu faiblement ou sont susceptibles de répondre faiblement à des antimicrobiens non critiques. Une utilisation accrue, notamment l’utilisation en dehors des recommandations du Résumé des Caractéristiques du Produit (RCP), est susceptible d’augmenter la prévalence des bactéries résistantes au ceftiofur. Les directives officielles nationales et régionales sur l’utilisation des antimicrobiens doivent être prises en compte lors de l’utilisation du produit.
Dans la mesure du possible, le médicament vétérinaire ne devrait être utilisées qu’après avoir réalisé un test de sensibilité. Il est recommandé de prendre en compte la gestion globale du troupeau et d’utiliser des traitements de soutien avec des produits locaux adaptés (par ex. désinfectants) lors de la mise en place du traitement.
Ne pas utiliser en prophylaxie de routine des rétentions placentaires.- Précaution particulière à prendre par la personne qui administre le médicament
Les pénicillines et les céphalosporines, comme le ceftiofur peuvent provoquer une hypersensibilité chez les humains et les animaux à la suite de leur injection, inhalation, ingestion ou au contact de la peau. L’hypersensibilité aux pénicillines peut conduire à des réactions croisées avec les céphalosporines et réciproquement. Les réactions allergiques à ces substances peuvent occasionnellement être graves.
En cas d'hypersensibilité connue aux pénicillines et céphalosporines, éviter tout contact avec le médicament vétérinaire.
Eviter le contact avec les yeux et la peau. En cas de contact rincer immédiatement à l’eau claire.
Si, à la suite d’une exposition, vous développez des symptômes comme un érythème cutané, ou une irritation persistante des yeux, consultez un médecin et montrez-lui la notice ou l’étiquette. Un œdème du visage, des lèvres, des yeux ou une difficulté respiratoire sont des symptômes plus sévères et nécessitent une consultation médicale d’urgence.- Précautions particulières concernant la protection de l'environnement
N/A
- Autres précautions
N/A
Interactions et cas particuliers
- Utilisation en cas de gravidité, de lactation ou de ponte
Les études de laboratoire sur la souris n’ont pas mis en évidence d’effets tératogènes, foetotoxiques ou maternotoxiques. Les études de laboratoires chez le rat ne révèlent pas d’effets tératogènes mais des effets maternotoxiques (fèces molles) et foetotoxiques (diminution du poids fœtal) ont été observés. Aucun effet sur les performances reproductrices n’a été observé. Aucune étude n’a été menée chez les vaches gestantes et les reproducteurs. L’utilisation ne doit se faire qu’après évaluation bénéfice/risque établie par le vétérinaire responsable.
Ce médicament vétérinaire peut être utilisé pendant la lactation.- Interactions médicamenteuses et autres formes d'interactions
Aucune connue.
- Anti-microbiens et anti-parasitaires : lutte contre les résistances
- Non renseigné
Effets indésirables et surdosage
- Surdosage (symptômes, conduite d'urgence, antidote)
- Incompatibilité majeure
En l’absence d’études de compatibilité, ce médicament vétérinaire ne doit pas être mélangé avec d’autres médicaments vétérinaires.
- Effets indésirables
Bovins:
Très fréquent
(>1 animal / 10 animaux traités):
Gonflement au site d’injection1, Douleur au site d’injection2 Très rare
(<1 animal / 10 000 animaux traités, y compris les cas isolés):
Anaphylaxie, Mort subite3 ¹Visible deux jours après l'injection chez environ deux tiers des animaux traités et disparaissant dans un délai maximum de 23 jours.
²Légère à modérée dans les premiers jours suivant l'injection.
³Suite à une administration intra-vasculaire accidentelle ou à une anaphylaxie.Il est important de notifier les effets indésirables. La notification permet un suivi continu de l’innocuité d’un médicament vétérinaire. Les notifications doivent être envoyées, de préférence par l’intermédiaire d’un vétérinaire, soit au titulaire de l’autorisation de mise sur le marché ou à son représentant local, soit à l’autorité nationale compétente par l’intermédiaire du système national de notification. Voir également la notice pour les coordonnées respectives.
Posologie
| Espèce(s) | Posologie |
|---|---|
| 6,6 mg ceftiofur /kg de poids vif (équivalent à 1 ml de médicament vétérinaire pour 30 kg de poids vif) en administration unique par voie sous-cutanée à la base de l’oreille.
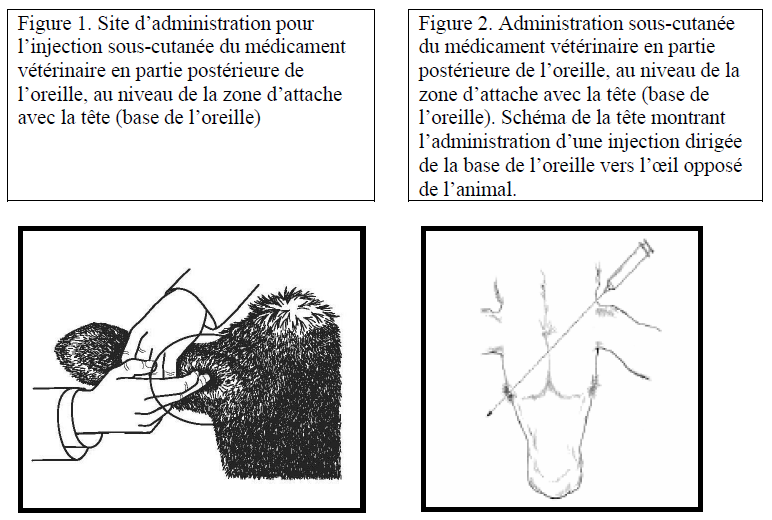 Si les signes cliniques ne s’améliorent pas 48 heures après le traitement, le diagnostic et le traitement doivent être réévalués. |
Temps d'attente
Conservation et stockage
- Température de conservation
- Non renseigné
- Précautions particulières de conservation selon pertinence
- Non renseigné
- Précaution particulière à prendre lors de l'élimination
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Utiliser les dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné.
Informations commerciales
| Présentation | Accessible au groupement | Classement du médicament en matière de délivrance | Numéro d'autorisation de mise sur le marché |
|---|---|---|---|
| Boîte de 1 flacon de 100 mL | Non | Soumis à prescription | EU/2/05/053/003 |
Informations de révision
- Date de révision de la notice
Responsabilités
- Responsable (Titulaire de l'autorisation de mise sur le marché)
- Zoetis Belgium
- Responsable (Responsable de la mise sur le marché)
- ZOETIS France
- Responsable (Responsable de la pharmacovigilance)
- ZOETIS France
