KELACTIN® 50 µg/mL Solution buvable pour chiens et chats
Identification
- Dénomination du médicament vétérinaire
- KELACTIN® 50 µg/mL Solution buvable pour chiens et chats
- Forme pharmaceutique
- Solution buvable
Composition
- Principes actifs
Nom du principe actif Quantité de principe actif Cabergoline 50 µg - Excipients
Nom de l'excipient Triglycérides à chaîne moyenne Azote, faible teneur en oxygène
Usage clinique
Indications d'utilisation par espèce
| Espèce(s) | Utilisation |
|---|---|
| Chez la chienne :
|
|
|
- Contre-indications
- Ne pas utiliser chez les animaux gestants car ce produit peut provoquer un avortement.
Ne pas utiliser en association avec un antagoniste de la dopamine. - Ne pas utiliser en cas d'hypersensibilité à la substance active ou à l'un des excipients.
La cabergoline est susceptible d'induire une hypotension transitoire chez les animaux traités. Ne pas utiliser chez les animaux traités concomitamment par des médicaments hypotenseurs. Ne pas utiliser immédiatement après une intervention chirurgicale, lorsque l'animal est encore sous l'influence de produits anesthésiques.
- Ne pas utiliser chez les animaux gestants car ce produit peut provoquer un avortement.
Précautions et mises en garde
- Mise en garde particulière à chaque espèce cible
Un traitement hygiénique complémentaire doit inclure une restriction de la consommation d'eau et de glucides et une augmentation de l'exercice.
- Précautions particulières pour une utilisation sûre chez les espèces cibles
Sans objet.
- Précaution particulière à prendre par la personne qui administre le médicament
Se laver les mains après utilisation. Éviter tout contact avec la peau, la bouche ou les yeux. Nettoyer immédiatement les éventuelles éclaboussures.
Les femmes en âge d'avoir des enfants et les femmes qui allaitent ne doivent pas manipuler le produit ou doivent porter des gants jetables lors de l'administration du produit.
Les personnes présentant une hypersensibilité connue à la cabergoline ou à l'un des autres ingrédients du produit devraient éviter tout contact avec le médicament vétérinaire.
Ne pas laisser de seringues pleines sans surveillance en présence d'enfants. En cas d'ingestion accidentelle, en particulier par un enfant, demander immédiatement conseil à un médecin et montrez-lui la notice ou l'étiquetage- Précautions particulières concernant la protection de l'environnement
Les conditionnements vides et tout reliquat de produit doivent être éliminés suivant les pratiques en vigueur régies par la réglementation sur les déchets.
- Autres précautions
Aucune.
Interactions et cas particuliers
- Utilisation en cas de gravidité, de lactation ou de ponte
La cabergoline peut provoquer un avortement à un stade avancé de la gestation et ne doit pas être utilisée chez les animaux gestants. Un diagnostic différentiel entre une gestation et une pseudo-gestation doit être correctement établi.
Le produit est indiqué pour le tarissement de la sécrétion lactée : l'inhibition de la sécrétion de prolactine par la cabergoline induit un arrêt rapide de la lactation et une réduction de la taille des glandes mammaires. Le produit ne doit pas être utilisé chez les animaux qui allaitent, sauf si un tarissement est nécessaire.- Interactions médicamenteuses et autres formes d'interactions
Comme la cabergoline agit par stimulation directe des récepteurs de la dopamine, le produit ne doit pas être administré en même temps que des médicaments dotés d'une activité antagoniste de la dopamine (par exemple phénothiazines, butyrophénones, métoclopramide), car ces derniers risquent de diminuer ses effets inhibiteurs de la prolactine.
La cabergoline pouvant induire une hypotension transitoire, le produit ne doit pas être administré à des animaux traités simultanément par des médicaments hypotenseurs.
Effets indésirables et surdosage
- Incompatibilité majeure
Ne pas mélanger le produit avec une solution aqueuse (par exemple du lait).
En l'absence d'études de compatibilité, ce médicament vétérinaire ne doit pas être mélangé avec d'autres médicaments vétérinaires.- Effets indésirables
Les effets indésirables potentiels sont :
- somnolence ;
- anorexie ;
- vomissements.
Ces effets indésirables sont généralement d'intensité modérée et transitoires.
Des vomissements ne surviennent généralement qu'après la première administration. En pareil cas, il n'est pas nécessaire d'interrompre le traitement, car les vomissements ne se reproduiront pas après l'administration suivante.
Dans de très rares cas, des réactions allergiques telles qu'œdème, urticaire, dermatite et prurit sont susceptibles de se produire.Dans de très rares cas, une hypotension transitoire est susceptible de se produire.
Dans de très rares cas, des symptômes neurologiques tels que somnolence, tremblements musculaires, ataxie, hyperactivité et convulsions sont susceptibles de se produire.La fréquence des effets indésirables est définie en utilisant la convention suivante :
- très fréquent (effets indésirables chez plus d’1 animal sur 10 au cours d’un traitement)
- fréquent (entre 1 et 10 animaux sur 100)
- peu fréquent (entre 1 et 10 animaux sur 1 000)
- rare (entre 1 et 10 animaux sur 10 000)
- très rare (moins d’un animal sur 10 000, y compris les cas isolés).
Posologie
| Espèce(s) | Posologie |
|---|---|
| Le médicament vétérinaire doit être administré oralement, soit directement dans la bouche, soit mélangé à la nourriture. Le poids des animaux traités doit être déterminé de manière précise avant l'administration.
Préparation du flacon pour la première utilisation : Placer le flacon sur une surface plane. Placer l’adaptateur sur le dessus du flacon à la verticale de façon à ce que la pointe de l’adaptateur transperce le bouchon en son centre. Fixer solidement l’adaptateur sur le flacon en l’enfonçant. Dès lors, l’adaptateur reste fixé en permanence sur le flacon. Cela permet au flacon de rester solidement scellé et de disposer d’un produit prêt à l’emploi jusqu’à ce que le flacon soit vide.
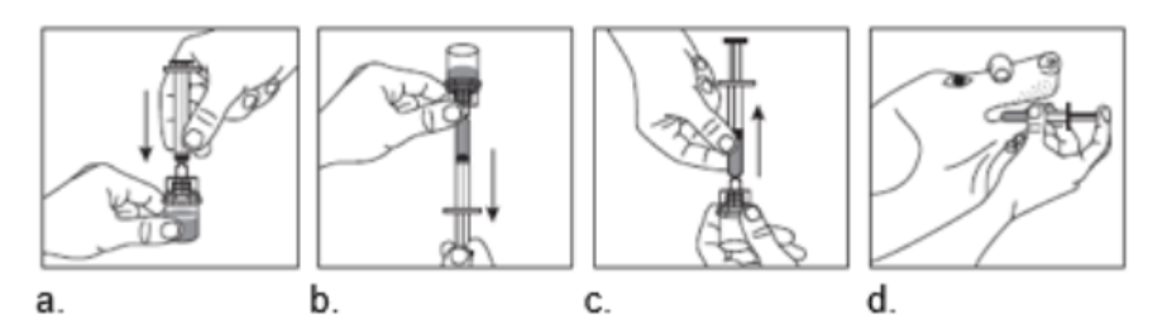
Prélèvement de la quantité requise/prescrite :
a. Fixer la seringue à l’adaptateur en enfonçant fermement la seringue dans l’adaptateur pour flacon, de manière à éviter toute fuite du médicament vétérinaire lors du prélèvement de la dose du flacon. b. Retourner et aspirer le médicament vétérinaire au départ du flacon dans la seringue en maintenant le flacon la tête en bas. c. Retirer la seringue de l’adaptateur en la tenant à la verticale. Laisser l’adaptateur sur le flacon. d. Le médicament vétérinaire est à présent prêt à être administré.
Il est recommandé de rincer et de sécher la seringue après chaque application. Pour le prochain prélèvement du produit, reprendre à l’étape a. |
Temps d'attente
- Voie d'administration
- Orale
| Espèce(s) | Denrée | Temps d'attente |
|---|---|---|
| 0 Sans objet |
Conservation et stockage
- Température de conservation
Tel que conditionné pour la vente : à conserver au réfrigérateur (entre +2°C et +8°C).
- Précautions particulières de conservation selon pertinence
Conserver en position verticale.
Conserver le flacon dans la boîte en carton afin de le protéger de la lumière.
Ne pas congeler.- Précaution particulière à prendre lors de l'élimination
Les conditionnements vides et tout reliquat de produit doivent être éliminés suivant les pratiques en vigueur régies par la réglementation sur les déchets.
Informations commerciales
| Présentation | Accessible au groupement | Classement du médicament en matière de délivrance | Numéro d'autorisation de mise sur le marché |
|---|---|---|---|
| Boîte contenant 1 flacon de 7 mL, 1 adaptateur et 1 seringue graduée de 1 mL | Oui | Soumis à prescription | FR/V/2255430 9/2012 |
| Boîte contenant 1 flacon de 24 mL, 1 adaptateur et 1 seringue graduée de 3 mL | Oui | Soumis à prescription | FR/V/2255430 9/2012 |
| Boîte contenant 1 flacon de 14 mL, 1 adaptateur et 1 seringue graduée de 3 mL | Oui | Soumis à prescription | FR/V/2255430 9/2012 |
Informations de révision
- Date de révision de la notice
- 1/1/1970
Responsabilités
- Titulaire de l'autorisation de mise sur le marché
- VEYX-PHARMA
- SÖHREWEG 6 34639 SCHWARZENBORN ALLEMAGNE
- Responsable de la mise sur le marché
- Laboratoire DESTAING
- 45 bd Marcel Pagnol
06130 Grasse
Tél:04.93.42.02.00
Fax:04.93.42.03.00https://www.destaing.com
- Responsable de la pharmacovigilance
- Laboratoire DESTAING
- 45 bd Marcel Pagnol
06130 Grasse
Tél:04.93.42.02.00
Fax:04.93.42.03.00https://www.destaing.com