BRAVECTO® Injectable
Identification
- Dénomination du médicament vétérinaire
- BRAVECTO® Injectable
- Forme pharmaceutique
- Solution injectable
Composition
- Principes actifs
- Fluralaner
- Excipients
- Informations supplémentaires
Flacon de poudre :
Substance active :
Fluralaner 2,51 g
Poudre blanche à jaune pâle.Flacon de solvant :
Chaque mL de solvant contient :Excipients :
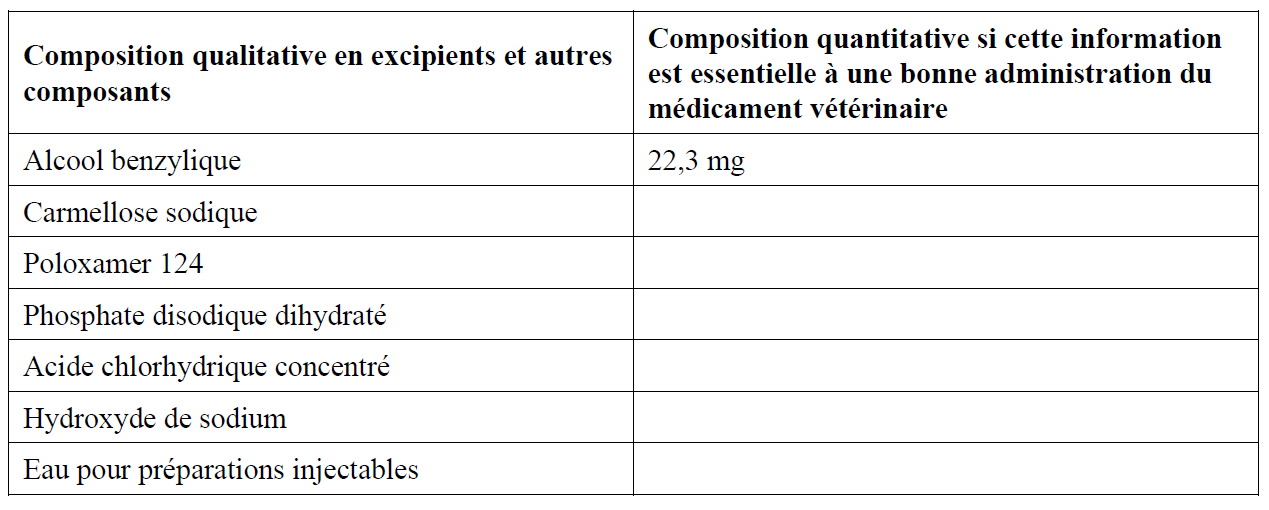
Solution visqueuse claire à opaque.Suspension reconstituée :
Chaque mL de suspension reconstituée contient :
Substance active :
Fluralaner 150 mg
Excipients :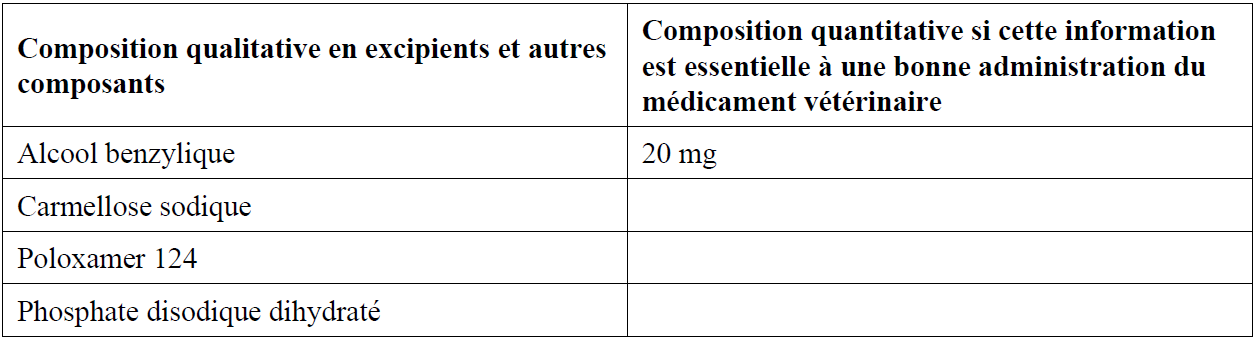

Usage clinique
Indications d'utilisation par espèce
| Espèce(s) | Utilisation |
|---|---|
| Traitement des infestations par les tiques et les puces chez les chiens. |
- Contre-indications
Ne pas utiliser en cas d’hypersensibilité à la substance active ou à l’un des excipients.
Précautions et mises en garde
- Mise en garde particulière à chaque espèce cible
Pour pouvoir être exposés au fluralaner, les parasites doivent avoir commencé à se nourrir sur l’animal ; par conséquent, le risque de transmission de maladies d’origine parasitaire (incluant Babesia canis canis et D. caninum) ne peut être complètement exclu.
L'utilisation non nécessaire d'antiparasitaires ou s'écartant des instructions données, peut augmenter la pression de sélection des résistances et conduire à une réduction de l’efficacité. La décision d'utiliser le médicament vétérinaire doit être fondée sur la confirmation de l'espèce parasitaire et de la charge parasitaire, ou du risque d'infestation sur la base de ses caractéristiques épidémiologiques (compte tenu de la durée de l'effet du médicament vétérinaire de 12 mois), pour chaque animal. La possibilité que d'autres animaux du même foyer puissent être une source de réinfection ou de réinfestation par des parasites doit être envisagée et ces animaux doivent être traités si nécessaire avec un médicament vétérinaire approprié.- Précautions particulières pour une utilisation sûre chez les espèces cibles
L’innocuité du médicament vétérinaire n'a pas été évaluée chez les chiens en cas d’épilepsie préexistante.
Par conséquent, utiliser avec prudence chez ces chiens sur la base d'une évaluation du rapport bénéfice/risque établie par le vétérinaire responsable.
En l’absence de données disponibles, le médicament vétérinaire ne doit pas être utilisé chez les chiens âgés de moins de 6 mois.- Précaution particulière à prendre par la personne qui administre le médicament
Des réactions d’hypersensibilité au fluralaner ou à l’alcool benzylique chez les humains ont été rapportées, ce qui peut être potentiellement grave. De plus, des réactions au point d’injection peuvent se produire. Des précautions doivent être prises afin d’éviter toute auto-injection accidentelle et exposition cutanée lors de l’administration de ce médicament vétérinaire. En cas d’auto-injection accidentelle avec des effets indésirables, de réaction d’hypersensibilité ou de réaction au point d’injection, contactez un médecin et montrez-lui l’étiquette ou la notice. Se laver les mains après utilisation.
Ce médicament vétérinaire ne doit être administré que par des vétérinaires ou sous leur étroite surveillance.- Précautions particulières concernant la protection de l'environnement
Sans objet
- Autres précautions
Aucune.
Interactions et cas particuliers
- Utilisation en cas de gravidité, de lactation ou de ponte
L’innocuité du médicament vétérinaire n’a pas été établie en cas de gestation et de lactation.
L’utilisation ne doit se faire qu’après évaluation du rapport bénéfice/risque établie par le vétérinaire responsable.- Interactions médicamenteuses et autres formes d'interactions
Le fluralaner est fortement lié aux protéines plasmatiques. Cela peut entraîner une compétition avec d’autres substances actives fortement liées aux protéines plasmatiques comme les anti-inflammatoires non stéroïdiens (AINS) et la warfarine, un dérivé de la coumarine. L’incubation du fluralaner en présence de carprofène ou de warfarine dans du plasma de chien aux concentrations maximales attendues dans le plasma n’a pas réduit la liaison du fluralaner, du carprofène ou de la warfarine avec les protéines plasmatiques.
Lors des essais cliniques terrain, aucune interaction n’a été observée entre le médicament vétérinaire et des médicaments vétérinaires utilisés de façon routinière.- Anti-microbiens et anti-parasitaires : lutte contre les résistances
Sans objet.
Effets indésirables et surdosage
- Incompatibilité majeure
En l’absence d’études de compatibilité, ce médicament vétérinaire ne doit pas être mélangé avec d’autres médicaments vétérinaires.
- Effets indésirables
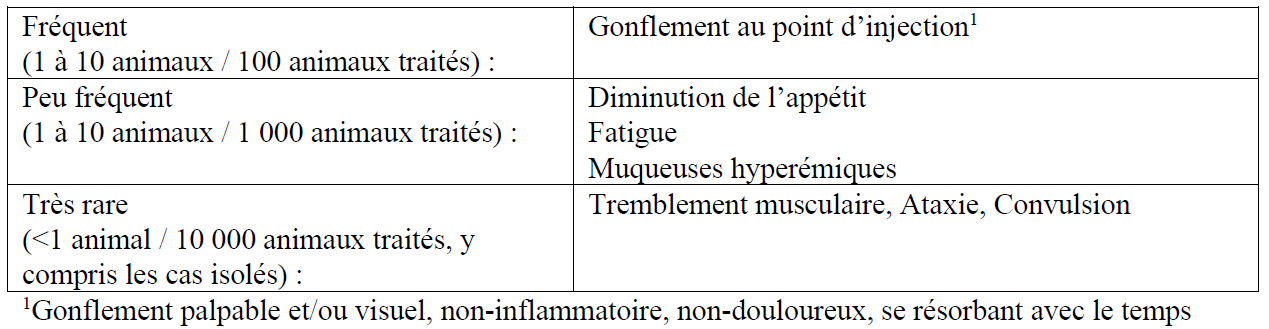
Il est important de notifier les effets indésirables. La notification permet un suivi continu de l’innocuité d’un médicament vétérinaire. Les notifications doivent être envoyées, de préférence par l’intermédiaire d’un vétérinaire, soit au titulaire de l’autorisation de mise sur le marché, soit à l’autorité nationale compétente par l’intermédiaire du système national de notification. Voir la notice pour les coordonnées respectives.
Posologie
| Espèce(s) | Posologie |
|---|---|
| Voie sous-cutanée. 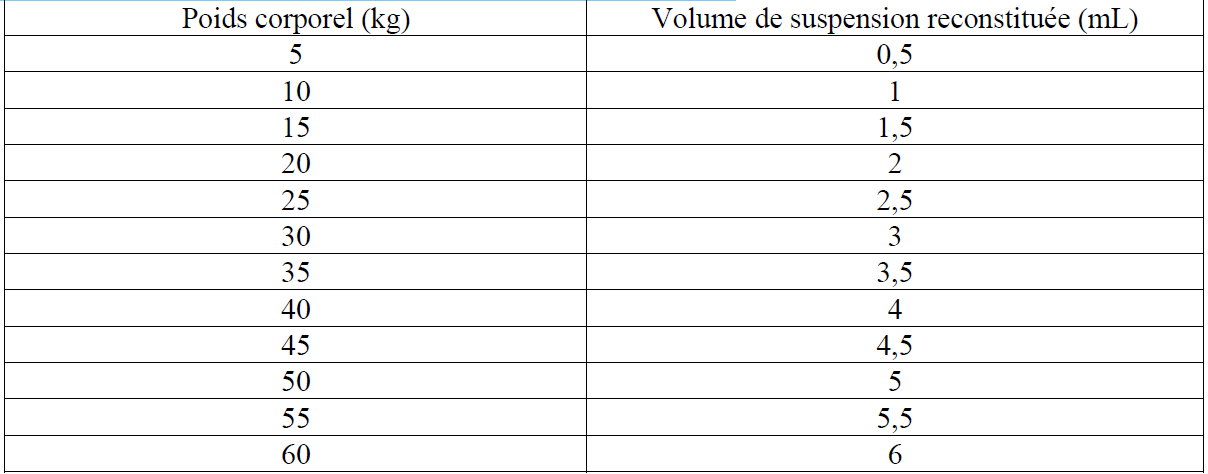 Calculez la dose en conséquence pour les chiens pesant moins de 5 kg ou plus de 60 kg.
Le flacon contient plus de solvant que nécessaire pour la reconstitution. Jetez le flacon avec le reste du solvant.
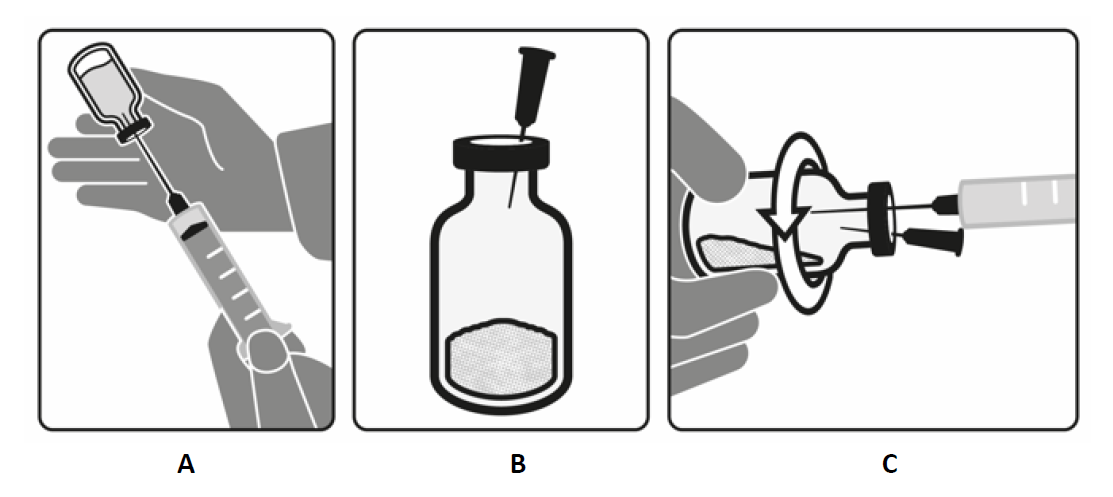 6. Une fois le solvant ajouté, enlevez l’aiguille de ventilation et l’aiguille de transfert du flacon de poudre de fluralaner. Jetez les aiguilles.
Méthode d’administration de la suspension reconstituée au chien :
|
Temps d'attente
- Voie d'administration
- Sous-cutanée
Conservation et stockage
- Température de conservation
Ce médicament vétérinaire tel que conditionné pour la vente ne nécessite pas de conditions particulières de conservation en ce qui concerne la température.
- Précautions particulières de conservation selon pertinence
- Non renseigné
- Précaution particulière à prendre lors de l'élimination
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Le médicament vétérinaire ne doit pas être déversé dans les cours d’eau car le fluralaner pourrait mettre les invertébrés aquatiques en danger.Utiliser les dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné.
Informations commerciales
| Présentation | Accessible au groupement | Classement du médicament en matière de délivrance | Numéro d'autorisation de mise sur le marché |
|---|---|---|---|
| BRAVECTO® 150 mg/mL poudre et solvant pour suspension injectable pour chiens | Non | Administration exclusivement réservée aux vétérinaires | EU/2/13/158/032-035 |
Informations de révision
- Date de révision de la notice
- 1/1/1970, 01:00 AM
Responsabilités
- Titulaire de l'autorisation de mise sur le marché
- INTERVET INTERNATIONAL B.V.
- WIM DE KORVERSTRAAT 35
5831 AN BOXMEER
PAYS-BAS
- Responsable de la mise sur le marché
- INTERVET
- Rue Olivier de Serres
BP 17144
49071 BEAUCOUZE cedex
- Responsable de la pharmacovigilance
- INTERVET
- Rue Olivier de Serres
BP 17144
49071 BEAUCOUZE cedex
