MometamaxⓇ Ultra suspension auriculaire en gouttes pour chiens
Identification
- Dénomination du médicament vétérinaire
- MometamaxⓇ Ultra suspension auriculaire en gouttes pour chiens
- Forme pharmaceutique
- Suspension auriculaire en gouttes
Composition
- Principes actifs
- Posaconazole
- Furoate de mométasone monohydraté
- Sulfate de gentamicine
- Paraffine liquide
- Gel hydrocarboné plastique (polyéthylène, huile minérale)
- Excipients
- Informations supplémentaires
Chaque dose (0,8 mL) contient :
Substances actives :
Sulfate de gentamicine équivalent à 6880 IU de gentamicine
Posaconazole 2,08 mg
Furoate de mométasone monohydraté équivalent à 1,68 mg de furoate de mométasone
Excipients :
Composition qualitative en excipients et autres composants Paraffine liquide Gel hydrocarboné plastique (polyéthylène, huile minérale) Blanc à blanc-cassé, suspension visqueuse.
Usage clinique
Indications d'utilisation par espèce
| Espèce(s) | Utilisation |
|---|---|
| Traitement de l'otite externe aiguë ou de crise aiguë d'une otite externe récurrente causée par des infections bactériennes et fongiques mixtes avec Staphylococcus pseudintermedius et Malassezia pachydermatis. |
- Contre-indications
Ne pas utiliser en cas d’hypersensibilité aux substances actives ou à l’un des excipients, aux corticostéroïdes, à d’autres agents antifongiques azolés et à d’autres aminoglycosides.
Ne pas utiliser en cas de tympan perforé.
Ne pas utiliser sur les animaux en gestation ou sur les animaux reproducteurs.
Ne pas utiliser en même temps que des substances connues pour provoquer une ototoxicité.
Ne pas utiliser sur les chiens ayant une démodécie généralisée.
Précautions et mises en garde
- Mise en garde particulière à chaque espèce cible
L'activité antimicrobienne peut être réduite par un pH faible et la présence de débris purulents et/ou inflammatoires. Les oreilles doivent être nettoyées avant l'administration du médicament vétérinaire. La compatibilité avec les produits nettoyants auriculaires n'a pas été démontrée.
Les otites bactériennes et fongiques sont souvent secondaires à d'autres affections. Chez les animaux ayant des antécédents d'otites externes récurrentes, les causes sous-jacentes de l'affection, telles que de l'allergie ou la conformation anatomique de l'oreille, doivent être recherchées afin d'éviter un traitement inefficace avec ce médicament vétérinaire. L'efficacité de ce médicament vétérinaire n'a pas été évaluée chez les chiens souffrant d'affections cutanées atopiques ou allergiques.
Une résistance croisée entre la gentamicine et d'autres membres de la classe des aminoglycosides a été mise en évidence chez Staphylococcus pseudintermedius. L'utilisation du médicament vétérinaire doit être soigneusement étudiée lorsque les antibiogrammes ont montré une résistance aux aminoglycosides, car son efficacité peut être réduite. La co-sélection pour la résistance à d'autres classes d'antimicrobiens est courante (voir rubrique 4.2).
- Précautions particulières pour une utilisation sûre chez les espèces cibles
L’innocuité du médicament vétérinaire n’a pas été démontrée sur les chiens âgés de moins de 3 mois ou sur les chiens pesant moins de 3kg.
Avant l’application du médicament vétérinaire, le canal auditif externe doit être soigneusement examiné pour s’assurer que le tympan ne soit pas perforé, afin d’éviter le risque de transmission d’infection à l’oreille moyenne et de prévenir des dommages aux appareils cochléaire et vestibulaire.
Réexaminer immédiatement le chien si une aggravation des signes cliniques, une perte de l’audition ou des signes de dysfonctionnement vestibulaire sont observés pendant le traitement ou si le chien ne montre pas de signe d’amélioration au 14ème jour.
Une cytologie du conduit auditif est recommandée avant l'utilisation du médicament vétérinaire pour identifier une infection mixte.
Cette association antimicrobienne doit être utilisée uniquement lorsque les tests diagnostiques ont indiqué la nécessité d'une administration simultanée de chacune des substances actives.
L’utilisation du médicament vétérinaire doit être basée sur les tests d’identification et de sensibilité des pathogènes cibles. Idéalement, la thérapie doit être basée sur les informations épidémiologiques et les connaissances concernant la sensibilité des pathogènes cibles au niveau local/régional.
L'utilisation du médicament vétérinaire doit être en accord avec les politiques antimicrobiennes officielles, nationales et régionales.
Si une hypersensibilité à l’un des composants apparait, le traitement doit être interrompu et un traitement approprié doit être instauré.
En cas d’otite parasitaire, un traitement acaricide approprié doit être ajouté.
L'utilisation prolongée et intensive de préparation de corticostéroïdes topiques est connue pour avoir des effets au niveau systémique, incluant la suppression des fonctions surrénaliennes (voir rubrique 3.10).
A utiliser avec précaution chez les chiens ayant des troubles endocriniens suspectés ou confirmés (c.-à-d. diabète sucré ; hypothyroïdie, etc.).
L’ototoxicité peut être dûe à un traitement à la gentamycine. L’expérience montre que les chiens âgés ont des risques plus élevés de déficience auditive après une administration de médicaments vétérinaires topiques auriculaires.
Des évaluations objectives de l’audition n’ont pas été opérées lors des essais pivots sur le terrain. Les chiens présentant des signes de troubles de l’équilibre ou de perte d’audition après administration doivent être réexaminés.
- Précaution particulière à prendre par la personne qui administre le médicament
Le médicament vétérinaire peut être légèrement irritant pour les yeux. Une exposition oculaire accidentelle peut arriver si le chien se secoue la tête pendant ou juste après l’administration. En cas de contact accidentel avec les yeux, rincer immédiatement et abondamment avec de l’eau pendant 15 minutes. Si des symptômes se développent, demandez conseil à un médecin et montrez-lui la notice ou l’étiquette.
Bien qu’aucun potentiel irritant pour la peau n’ait été indiqué par les études expérimentales, le contact de ce médicament vétérinaire avec la peau doit être évité. En cas de contact accidentel avec la peau, laver la partie de la peau exposée à l’eau.
Le contact rapproché entre le chien et des enfants doit être limité dans les jours suivants le traitement en raison du fait qu’une quantité inconnue de médicament vétérinaire peut s’échapper de l’oreille (ou des oreilles) traitée(s).
Le médicament vétérinaire peut être nocif après ingestion. Eviter l’ingestion du médicament vétérinaire en incluant l’exposition de la main à la bouche. En cas d’ingestion accidentelle, demandez immédiatement conseil à un médecin et montrez-lui la notice ou l’étiquette.
- Précautions particulières concernant la protection de l'environnement
Sans objet.
- Autres précautions
Aucune.
Interactions et cas particuliers
- Utilisation en cas de gravidité, de lactation ou de ponte
L’innocuité du médicament vétérinaire n’a pas été établie en cas de gestation et de lactation.
Gestation et lactation :
Ne pas utiliser durant la gestation et la lactation.
Fertilité :
Les études pour déterminer l’effet du produit sur la fertilité chez les chiens n’ont pas été menées.
Ne pas utiliser sur les animaux destinés à la reproduction.
- Interactions médicamenteuses et autres formes d'interactions
Aucune connue.
- Anti-microbiens et anti-parasitaires : lutte contre les résistances
Administration exclusivement réservée au vétérinaire.
Effets indésirables et surdosage
- Incompatibilité majeure
Aucune connue.
- Effets indésirables
Chiens :
Aucun effet indésirable lié à ce traitement n’a été observé lors des essais cliniques.
Il est important de notifier les effets indésirables. La notification permet un suivi continu de l’innocuité d’un médicament vétérinaire. Les notifications doivent être envoyées, de préférence par l’intermédiaire d’un vétérinaire, soit au titulaire de l’autorisation de mise sur le marché, soit à l’autorité nationale compétente par l’intermédiaire du système national de notification. Voir la notice pour les coordonnées respectives.
Posologie
| Espèce(s) | Posologie | ||||||
|---|---|---|---|---|---|---|---|
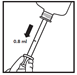
| Voie auriculaire. Traitement unique. La dose recommandée est une dose unique de 0,8 mL par oreille infectée.
La réponse clinique maximale peut ne pas être observée avant 28 à 42 jours après administration.
Instructions d’utilisation :
Le médicament vétérinaire doit être administré uniquement par un vétérinaire ou par une personne formée sous la supervision étroite d’un vétérinaire.
Nettoyer et sécher le conduit externe de l’oreille avant administration du médicament vétérinaire.
Le médicament vétérinaire est sans conservateur et doit être manipulé dans le respect de conditions d’hygiène classiques.
Utiliser une nouvelle seringue pour chaque oreille infectée. Secouer vigoureusement le flacon pendant 15 secondes avant chaque utilisation. Retirer le bouchon. Insérer la pointe de la seringue dans l’adaptateur. Suivre les étapes 1 à 5 des instructions de dosage.
Il est recommandé de ne pas répéter le nettoyage des oreilles dans les 28 jours suivant l’administration à moins que cela ne soit cliniquement indiqué. Il faut également veiller à éviter l’entrée d’eau dans le canal auditif durant cette période. Pour cette raison, les chiens ne doivent pas être baignés ni autorisés à nager jusqu’à la confirmation de la guérison clinique 28-42 jours après le traitement.
Les chiens doivent être réexaminés 28-42 jours après l’administration du médicament vétérinaire pour évaluer la réponse au traitement. Après confirmation de la résolution clinique, les oreilles doivent être nettoyées pour éliminer tout débris ou médicament vétérinaire résiduel. |
Temps d'attente
- Voie d'administration
- Auriculaire
Conservation et stockage
- Température de conservation
- Non renseigné
- Précautions particulières de conservation selon pertinence
Ce médicament vétérinaire ne nécessite pas de conditions particulières de conservation.
- Précaution particulière à prendre lors de l'élimination
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Utiliser les dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné.
Informations commerciales
| Présentation | Accessible au groupement | Classement du médicament en matière de délivrance | Numéro d'autorisation de mise sur le marché |
|---|---|---|---|
| Boîte contenant 1 flacon de 20 doses et de 20 seringues de 1 mL et 1 adaptateur | Non | Soumis à prescription | EU/2/22/289/001 |
Informations de révision
- Date de révision de la notice
- 1/1/1970, 01:00 AM
Responsabilités
- Titulaire de l'autorisation de mise sur le marché
- INTERVET INTERNATIONAL B.V.
- WIM DE KORVERSTRAAT 35
5831 AN BOXMEER
PAYS-BAS
- Responsable de la mise sur le marché
- INTERVET
- Rue Olivier de Serres
BP 17144
49071 BEAUCOUZE cedex
- Responsable de la pharmacovigilance
- INTERVET
- Rue Olivier de Serres
BP 17144
49071 BEAUCOUZE cedex