PROTECTIX 400 MG/2000 MG SOLUTION SPOT-ON POUR CHIENS DE 25 KG A 40 KG
Identification
- Dénomination du médicament vétérinaire
- PROTECTIX 400 MG/2000 MG SOLUTION SPOT-ON POUR CHIENS DE 25 KG A 40 KG
- Forme pharmaceutique
- Solution pour spot-on
Composition
- Principes actifs
Nom du principe actif Quantité de principe actif Imidaclopride 400 mg Perméthrine 2000 mg - Excipients
Nom de l'excipient Quantité de l'excipient Butylhydroxytoluène (E321) 4 mg N-méthylpyrrolidone 1871.6 mg Triglycérides à chaîne moyenne Acide citrique (E330)
Usage clinique
Indications d'utilisation par espèce
| Espèce(s) | Utilisation |
|---|---|
| Traitement et prévention des infestations par les puces (Ctenocephalides canis, Ctenocephalides felis).
Les puces sur les chiens sont tuées dans les 24 heures qui suivent le traitement. Un traitement prévient toute nouvelle infestation de puces pendant quatre semaines. Le médicament vétérinaire peut être utilisé dans le cadre d’une stratégie de traitement de la dermatite allergique aux puces.
Le médicament vétérinaire a une efficacité acaricide et répulsive persistante contre les infestations par les tiques (Rhipicephalus sanguineus et Ixodes ricinus pendant quatre semaines et Dermacentor reticulatus pendant trois semaines). Par son action répulsive et acaricide sur la tique vectrice Rhipicephalus sanguineus, le médicament vétérinaire réduit la probabilité de transmission du pathogène Ehrlichia canis, réduisant ainsi le risque d’ehrlichiose canine. Les études ont montré que cette protection commence dès le 3ème jour après l’application du produit et persiste pendant 4 semaines. Les tiques déjà présentes sur le chien au moment du traitement peuvent ne pas être tuées pendant les 2 jours qui suivent l’administration du traitement et peuvent rester attachées et visibles. Par conséquent, il est recommandé de retirer les tiques déjà présentes sur le chien au moment du traitement, afin d’éviter leur attachement et la prise de repas sanguin.
Traitement des infestations par les poux broyeurs (Trichodectes canis).
Un traitement fournit une activité répulsive (anti-gorgement) contre : - les phlébotomes (Phlebotomus papatasi pendant deux semaines et Phlebotomus perniciosus pendant trois semaines), - les moustiques (Aedes aegypti pendant deux semaines et Culex pipiens pendant quatre semaines), - les mouches d’étable (Stomoxys calcitrans) pendant quatre semaines.
Réduction du risque d’infection par Leishmania infantum transmis par les phlébotomes (Phlebotomus perniciosus) pendant une période allant jusqu’à 3 semaines. L’effet est indirect en raison de l’activité du médicament vétérinaire contre le vecteur. |
- Contre-indications
En l’absence de données disponibles, le médicament vétérinaire ne doit pas être utilisé chez les chiots âgés de moins de 7 semaines ou pesant moins de 25 kg.
Ne pas utiliser en cas d’hypersensibilité à la substance active ou à l’un des excipients.
Ne pas utiliser sur les chats. La perméthrine est dangereuse pour les chats.
Précautions et mises en garde
- Mise en garde particulière à chaque espèce cible
La fixation d’une tique ou la piqûre d’un moustique ou d’un phlébotome reste possible. Par conséquent, la transmission de maladies infectieuses par ces parasites ne peut être totalement exclue si les conditions sont défavorables.
Il est recommandé d’appliquer le traitement au moins 3 jours avant l’exposition prévue à E. canis. En ce qui concerne E. canis, des études ont montré une réduction du risque d’ehrlichiose canine chez les chiens exposés à des tiques Rhipicephalus sanguineus infectées par E. canis à partir de 3 jours suivant l’application du médicament vétérinaire et avec une persistance de 4 semaines.
La protection immédiate contre les piqûres de phlébotomes n’est pas documentée. Les chiens traités pour la réduction du risque d’infection par Leishmania infantum transmis par des phlébotomes P. perniciosus doivent être gardés dans un environnement protégé pendant les 24 premières heures suivant l’application initiale du traitement.
Pour réduire la réinfestation due à l’émergence de nouvelles puces, il est recommandé de traiter tous les chiens du foyer. Les autres animaux vivant dans le même foyer doivent également être traités avec un médicament vétérinaire approprié. Afin d’obtenir une réduction supplémentaire de la pression parasitaire, il est recommandé d’utiliser en complément un traitement approprié de l’environnement contre les puces adultes et leurs stades de développement.
Le médicament vétérinaire reste efficace si l’animal est mouillé. Cependant, une exposition intense et prolongée à l’eau doit être évitée. En cas d’exposition fréquente à l’eau, l’efficacité persistante peut être réduite. Dans ce cas, un intervalle minimum d’une semaine doit être respecté entre deux applications. Si le chien doit être lavé avec un shampooing, il est recommandé de le faire avant l’application du médicament vétérinaire ou au moins 2 semaines après l’application, afin d’optimiser l’efficacité du médicament vétérinaire.
L’utilisation non nécessaire d’antiparasitaires ou l’utilisation non conforme aux instructions données dans le RCP peut augmenter la pression de sélection favorisant la résistance et conduire à une diminution de l’efficacité. La décision d’utiliser le produit doit être fondée sur la confirmation de l’espèce et de la charge parasitaire, ou du risque d’infection sur la base de ses caractéristiques épidémiologiques, pour chaque animal.
La résistance à la perméthrine a été rapportée chez les puces, les tiques (Rhipicephalus sanguineus), les mouches d’étable (Stomoxys calcitrans), les moustiques (Culex pipiens, Aedes aegypti) et les phlébotomes (P. papatasi). L’utilisation de ce produit doit tenir compte des informations locales sur la sensibilité des parasites cibles, lorsqu’elles sont disponibles. Il est recommandé de poursuivre les investigations sur les cas de résistance suspectée, en utilisant une méthode de diagnostic appropriée. La résistance confirmée doit être signalée au titulaire de l’autorisation de mise sur le marché ou aux autorités compétentes.
En l’absence de risque de co-infection par les puces, les tiques et/ou les phlébotomes, un produit à spectre étroit doit être utilisé.
- Précautions particulières pour une utilisation sûre chez les espèces cibles
Prendre les précautions nécessaires afin d’éviter tout contact du contenu de la pipette avec les yeux ou la bouche du chien à traiter.
Veiller à administrer le médicament vétérinaire correctement tel que décrit dans la rubrique 3.9. Veiller notamment à empêcher toute ingestion du produit par léchage du site d’application par les animaux traités ou par les animaux en contact avec ces derniers.
Ne pas utiliser sur les chats.

Ce médicament vétérinaire est extrêmement toxique chez les chats et peut être létal, étant donné la physiologie particulière des chats et leur incapacité à métaboliser certains composés dont la perméthrine. Afin d’éviter que les chats ne soient exposés accidentellement au médicament vétérinaire, tenir les chiens traités à l’écart des chats après le traitement jusqu’à ce que le site d’application soit sec. Il est important de s’assurer que les chats ne puissent lécher le site d’application d’un chien récemment traité avec le médicament vétérinaire. Si cela se produit, contacter immédiatement votre vétérinaire.
Consultez votre vétérinaire avant d’utiliser le médicament vétérinaire sur des chiens malades et affaiblis.
- Précaution particulière à prendre par la personne qui administre le médicament
Les personnes présentant une sensibilité cutanée connue peuvent être particulièrement sensibles à ce médicament vétérinaire.
Les symptômes cliniques prédominants qui, dans des cas extrêmement rares, peuvent être observés sont des irritations sensorielles transitoires de la peau comme un picotement, une sensation de brûlure ou un engourdissement.
Des études de laboratoire chez le lapin et le rat avec l’excipient N-méthylpyrrolidone ont montré des effets fœtotoxiques. Le médicament vétérinaire ne doit pas être administré par les femmes enceintes et les femmes susceptibles de l’être. Un équipement de protection individuelle composé de gants doit être porté lors de la manipulation du médicament vétérinaire par les femmes en âge de procréer. Les femmes enceintes et les femmes susceptibles de l’être doivent éviter tout contact direct avec l’animal traité pendant les 12 heures suivant l’application du produit.
Les animaux traités ne doivent pas être manipulés pendant au moins 12 heures après l’application du produit. Il est donc recommandé de traiter l’animal le soir. Les animaux traités ne doivent pas être autorisés à dormir avec leurs propriétaires, en particulier les enfants.
Afin d’éviter que les enfants aient accès aux pipettes, conservez la pipette dans son emballage d’origine jusqu’à ce qu’elle soit prête à l’emploi et jetez immédiatement les pipettes usagées.
Éviter tout contact entre le médicament vétérinaire et la peau, les yeux ou la bouche.
Ne pas manger, boire ou fumer pendant l’application.
Se laver soigneusement les mains après usage.
En cas de contact accidentel avec la peau, laver immédiatement avec de l’eau et du savon.
En cas de contact accidentel du médicament vétérinaire avec les yeux, rincez-les soigneusement à l’eau. Si l’irritation de la peau ou des yeux persiste, consulter immédiatement un médecin et lui montrer la notice ou l’étiquette.
Ne pas ingérer. En cas d’ingestion accidentelle, demander immédiatement conseil à un médecin et lui montrer la notice ou l’étiquetage.
Ce médicament contient du butylhydroxytoluène et peut provoquer des réactions cutanées locales (par exemple dermatite de contact) ou une irritation des yeux et des muqueuses.
- Précautions particulières concernant la protection de l'environnement
Pour prévenir les effets néfastes sur les organismes aquatiques, les chiens traités ne doivent pas accéder aux cours d’eau pendant 48 heures après le traitement.
- Autres précautions
Le solvant contenu dans le médicament vétérinaire peut tacher certains matériaux, notamment le cuir, les tissus, les plastiques et les surfaces texturées. Laisser sécher le site d’application avant de permettre le contact avec de tels matériaux.
Interactions et cas particuliers
- Utilisation en cas de gravidité, de lactation ou de ponte
Gestation et lactation :
L’innocuité du médicament vétérinaire n’a pas été établie en cas de gestation, lactation, ou chez les animaux destinés à la reproduction. Des études de laboratoire chez le lapin et le rat avec l’excipient N-méthylpyrrolidone ont montré des effets fœtotoxiques. L’utilisation ne doit se faire qu’après évaluation du rapport bénéfice/risque établie par le vétérinaire responsable.
- Interactions médicamenteuses et autres formes d'interactions
Aucune connue.
- Anti-microbiens et anti-parasitaires : lutte contre les résistances
Sans objet.
Effets indésirables et surdosage
- Incompatibilité majeure
En l’absence d’étude de compatibilité, ce médicament vétérinaire ne doit pas être mélangé avec d’autres médicaments vétérinaires.
- Effets indésirables
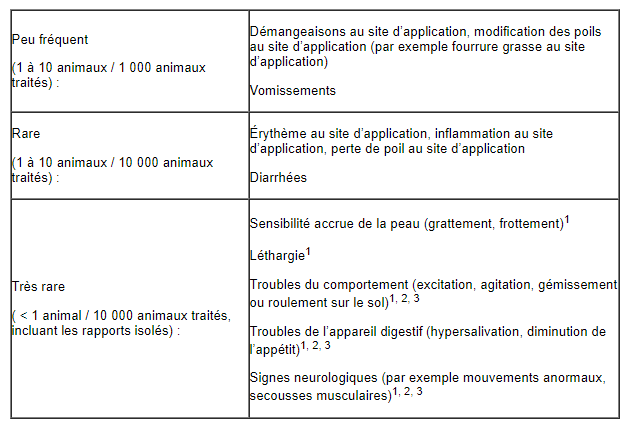
1 généralement auto-résolutifs, 2 transitoires, 3 chez les chiens sensibles à la perméthrine
Une intoxication consécutive à une absorption orale accidentelle chez le chien est peu probable, mais peut survenir dans de très rares cas. Dans ce cas, des signes neurologiques tels que tremblements et léthargie peuvent survenir. Le traitement doit être symptomatique. Il n’existe pas d’antidote connu.
Il est important de notifier les effets indésirables. La notification permet un suivi continu de l’innocuité d’un médicament vétérinaire. Les notifications doivent être envoyées, de préférence par l’intermédiaire d’un vétérinaire, soit au titulaire de l’autorisation de mise sur le marché ou à son représentant local, soit à l’autorité nationale compétente par l’intermédiaire du système national de notification. Voir la rubrique « coordonnées » de la notice.
Posologie
| Espèce(s) | Posologie |
|---|---|
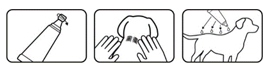
| Solution spot-on pour usage externe uniquement. Appliquer uniquement sur la peau intacte. Les animaux doivent être pesés avec précision avant le traitement.
La dose minimale de traitement est de 10 mg/kg de poids corporel (PC) d’imidaclopride et de 50 mg/kg de PC de perméthrine, ce qui équivaut à 1 pipette de 4,0 mL pour un petit chien ( ≥ 25 kg à 40 kg) correspondant à une dose de 10-16 mg/kg PC d’imidaclopride et de 50-80 mg/kg de PC de perméthrine.
Pour les chiens de plus de 25 kg jusqu’à 40 kg :
Sortir une pipette de l’emballage. Tenir la pipette en position verticale et dévisser le bouchon. En partant de l’épaule du chien, écarter le pelage et pressez pour libérer le contenu de la pipette à quatre endroits le long du dos du chien, en terminant à la base de la queue. Ne pas appliquer une quantité excessive de produit en un seul point ce qui pourrait causer le ruissellement de la solution sur les flancs du chien.
En cas d’infestation de poux broyeurs, un examen vétérinaire supplémentaire 30 jours après le traitement est recommandé, car certains animaux peuvent nécessiter un second traitement.
Pour protéger un chien pendant toute la saison des phlébotomes, le traitement doit être poursuivi de manière conforme pendant toute la période.
Un sous-dosage peut entraîner une utilisation inefficace et favoriser le développement de résistances. |
Temps d'attente
- Voie d'administration
- Usage externe
- Spot-on
Conservation et stockage
- Température de conservation
Ne pas mettre au réfrigérateur, ne pas congeler.
- Précautions particulières de conservation selon pertinence
Conserver les pipettes dans l’emballage d’origine afin de protéger contre la lumière et l’humidité.
- Précaution particulière à prendre lors de l'élimination
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Le médicament vétérinaire ne doit pas être déversé dans les cours d’eau, car la perméthrine et l’imidaclopride pourraient mettre les poissons et autres organismes aquatiques en danger.
Utiliser les dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné.
Informations commerciales
| Présentation | Accessible au groupement | Classement du médicament en matière de délivrance | Numéro d'autorisation de mise sur le marché |
|---|---|---|---|
| Boîte de 3 pipettes de dose unitaire | Oui | Non soumis à prescription | FR/V/1867164 5/2023 |
Informations de révision
- Date de révision de la notice
- 1/1/1970
Responsabilités
- Titulaire de l'autorisation de mise sur le marché
- BEAPHAR B.V.
- DROSTENKAMP 3
8101BX RAALTE
PAYS-BAS
- Responsable de la mise sur le marché
- BEAPHAR
- 2 ALLEE VIVALDI LE SAN GIORGIO
06800 CAGNES-SUR-MER
Francehttps://www.beaphar.fr/
- Responsable de la pharmacovigilance
- BEAPHAR
- 2 ALLEE VIVALDI LE SAN GIORGIO
06800 CAGNES-SUR-MER
Francehttps://www.beaphar.fr/
