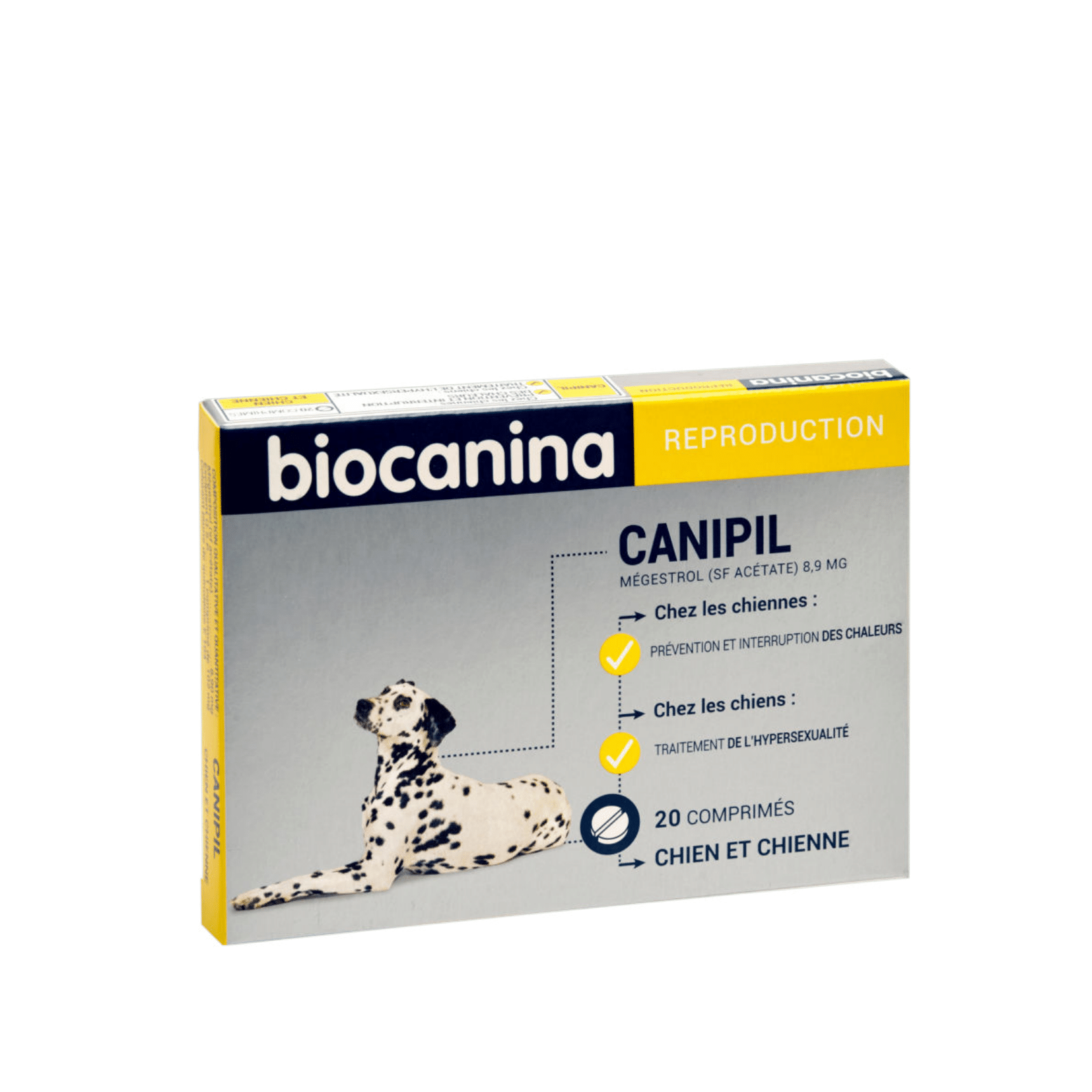
Composition
Principes actifs et excipients
Principes actifs
| Nom du principe actif | Quantité de principe actif |
|---|---|
| Mégestrol (sous forme d'acétate) | 8.9 mg/comprimé |
Excipients
| Nom de l'excipient | Quantité de l'excipient |
|---|---|
| Laque aluminique de jaune de quinoléine (E104) | 0.6 mg |
| Saccharose | |
| Amidon prégélatinisé | |
| Lactose monohydraté | |
| Amidon de blé | |
| Stéarate de magnésium | |
| Hypromellose | |
| Macrogol 400 |
Informations complémentaires
Comprimé pelliculé sécable de 102 mg.
Comprimé de couleur jaune avec une barre de sécabilité permettant une division en deux fractions égales.
Substance active :
Mégestrol 8,9 mg (sous forme d’acétate)
(Equivalant à 10 mg d’acétate de mégestrol)
Clinique
Indications d'utilisation par espèce
- Chien
- Chienne
Chez les chiennes :
- Prévention et interruption des chaleurs.
Chez les chiens :
- Traitement de l'hypersexualité.
Voie d'administration et posologie
Voie d'administration
- Orale
Posologie
- Chien
- Chienne
Le risque d’effet indésirable grave augmentant avec la durée de traitement, l’administration doit être limitée à une durée la plus courte possible. Le risque d’effet indésirable grave augmentant en cas de surdosage, l’animal doit être pesé avant prescription et la dose ajustée à son poids.
Chez les chiennes :
- Prévention des chaleurs.
Traiter un mois avant la date présumée des chaleurs.
0,5 mg d'acétate de mégestrol par kg de poids corporel et par jour pendant un mois, correspondant à 1 comprimé par jour pour 20 kg.
- Interruption des chaleurs.
Traiter dès les premiers signes de chaleurs.
2 mg d'acétate de mégestrol par kg de poids corporel et par jour pendant 8 jours, correspondant à 4 comprimés par jour pour 20 kg.
Les chaleurs seront de retour normalement environ 6 mois après la fin du traitement.
Chez les chiens :
- Traitement de l'hypersexualité
2 mg d'acétate de mégestrol par kg de poids corporel et par jour pendant 7 jours, puis en cas d'amélioration 1 mg d'acétate de mégestrol par kg de poids corporel et par jour pendant 14 jours, correspondant respectivement à 4 comprimés par jour puis à 2 comprimés par jour pour 20 kg.
Si aucune amélioration ne se produit, cesser le traitement.
Temps d'attente
Complément d'information temps d'attente
Sans objet.
Contre indications
Ne pas utiliser chez les femelles impubères, chez les femelles gestantes, chez les femelles sous imprégnation œstrogénique thérapeutique, en cas de pathologie(s) génitale(s), de tumeur(s) mammaire(s), d'insuffisance hépatique et chez les animaux diabétiques.
Mises en garde particulières à chaque espèce cible
Aucune.
Précautions particulières d'emploi
Précautions particulières pour une utilisation sûre chez les espèces cibles
En raison du risque d’effets indésirables graves, ce médicament doit être administré uniquement après une analyse bénéfice/risque réalisée par un vétérinaire. Le risque d’effet indésirable grave augmentant avec la durée de traitement, l’administration doit être limitée à une durée la plus courte possible. Le risque d’effet indésirable grave augmentant en cas de surdosage, l’animal doit être pesé avant prescription et la dose ajustée à son poids.
En cas d'administration trop tardive (au-delà du 3ième jour du cycle après l'apparition des chaleurs), l'ovulation risque de ne pas être bloquée rendant possible une éventuelle gestation.
Précautions particulières à prendre par la personne qui administre le médicament
L’acétate de mégestrol est un progestatif de synthèse qui peut entrainer des effets indésirables sur le système reproducteur.
Des effets indésirables sur les enfants à naître ne peuvent pas être exclus.
Les femmes enceintes ou en âge de procréer doivent manipuler le médicament avec précaution.
En cas d'ingestion accidentelle, notamment par un enfant, demandez immédiatement conseil à un médecin et montrez-lui la notice ou l'étiquette.
Se laver les mains après utilisation.
Afin d'empêcher les enfants d'accéder au produit, les comprimés doivent être administrés et conservés hors de la vue et de la portée des enfants. Les demi-comprimés non utilisés doivent être replacés dans la plaquette et remis dans la boîte.
Précautions particulières concernant la protection de l'environnement
Sans objet.
Autres précautions
Aucune.
Interactions médicamenteuses et autres formes d'interaction
Voir la rubrique "Contre-indications".
Utilisation en cas de gravidité de lactation ou de ponte
Ne pas administrer aux femelles gestantes.
Effets indésirables
Après administration unique ou répétée du produit, l’apparition d’affections de l'appareil génital (hypertrophies, pyomètres et tumeurs utérines), d’affections de la mamelle (hypertrophies, tumeurs mammaires), ainsi que des cas de diabète sucré et de modifications du comportement (polyphagie, agressivité, ou apathie), ont été très rarement rapportés.
En cas d’apparition d’effet(s) indésirable(s), cesser l’administration du médicament et contacter un vétérinaire.
La fréquence des effets indésirables est définie comme suit :
- très fréquent (effets indésirables chez plus d’1 animal sur 10 animaux traités)
- fréquent (entre 1 et 10 animaux sur 100 animaux traités)
- peu fréquent (entre 1 et 10 animaux sur 1 000 animaux traités)
- rare (entre 1 et 10 animaux sur 10 000 animaux traités)
- très rare (moins d’un animal sur 10 000 animaux traités, y compris les cas isolés).
Surdosage (symptômes, conduite d’urgences, antidotes)
Le risque de développer les effets indésirables mentionnés dans la rubrique « Effets indésirables (fréquence et gravité) » augmente en cas de surdosage.
Informations pharmacologiques ou immunologiques
codes ATC
QG03AC05 : mégestrol
Pharmacodynamie
L'acétate de mégestrol est un progestatif de synthèse. Son effet contraceptif n'est pas clairement élucidé. Il pourrait résulter d'altérations des concentrations de GnRH et des gonadotropines FSH et LH induites par une action inhibitrice du progestagène au niveau hypothalamo-hypophyso-ovarien, de l'altération du transport des ovocytes et de la fécondation liée à une perturbation des contractions tubaires et de la modification de l'environnement utérin conduisant à une altération de l'implantation.
L'acétate de mégestrol présente une affinité non sélective pour les récepteurs de la progestérone présents dans les organes cibles des hormones stéroïdes sexuelles, comme l'ovaire, l'utérus et la mamelle. A plus forte dose, il se lie aux récepteurs androgènes entraînant chez le mâle un effet anti-androgénique. Il favorise la production des facteurs de croissance (GH) et Insuline like Growth Factor (IGF 1-5), mais antagonise partiellement l'effet de l'insuline.
Pharmacocinétique et environnement
L'acétate de mégestrol est rapidement métabolisé après une administration par voie orale chez le chien, avec un temps de demi-vie terminal de 8 heures.
Près de 100 % de l'acétate de mégestrol et de ses métabolites, administré à la dose de 2 mg/kg pendant 8 jours par voie orale chez la chienne, sont excrétés dans les 2 semaines après la dernière administration (dont 75 % dans les 24 heures après la dernière administration). La principale voie d'élimination est fécale ; 90 % de la dose administrée est retrouvée dans les fèces.
Données pharmaceutiques
Incompatibilités majeures
Aucune connue.
Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 4 ans.
Précautions particulières de conservation selon pertinence
Aucune.
Précautions particulières à prendre lors de l'élimination de médicaments non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Les conditionnements vides et tout reliquat de produit doivent être éliminés suivant les pratiques en vigueur régies par la réglementation sur les déchets.
Nature et composition du conditionnement primaire
Titulaire de l'autorisation de mise sur le marché
DÔMES PHARMA
Z.A.C. de Champ Lamet 3 rue André Citroën 63430 PONT-DU-CHÂTEAU
http://www.domespharma.comPrésentations commercialisées et AMM
| Présentation | GTIN | Numéro d'autorisation de mise sur le marché | Date de première mise sur le marché (ou AMM) | Classement du médicament en matière de délivrance | Accessible aux groupements |
|---|---|---|---|---|---|
| CANIPIL® Boîte de 1 plaquette thermoformée de 20 comprimés pelliculés | 03661729236490 | FR/V/5504596 0/1987 | 7/22/1987 | Soumis à prescription | Non |
Responsable de la mise sur le marché
DÔMES PHARMA FR - Gamme BIOCANINA
DÔMES PHARMA FR - Division Officine - Gamme BIOCANINA 57, Rue des Bardines 63370 LEMPDES
https://www.biocanina.com/Responsable de la Pharmacovigilance
DÔMES PHARMA FR - Gamme BIOCANINA
DÔMES PHARMA FR - Division Officine - Gamme BIOCANINA 57, Rue des Bardines 63370 LEMPDES
https://www.biocanina.com/