
Composition
Principes actifs et excipients
Principes actifs
| Nom du principe actif | Quantité de principe actif |
|---|---|
| Dicyclanil | 50 mg/mL |
Excipients
| Nom de l'excipient | Quantité de l'excipient |
|---|---|
| Parahydroxybenzoate de méthyle (E 218) | 1.5 |
| Parahydroxybenzoate de propyle (E 216) | 3 |
| Butylhydroxytoluène (E 321) | 0.5 |
| Ponceau 4R (E 124) | 0.05 |
| Polysorbate 20 | |
| Copolymère d'acide acrylique (Pemulen TR-2NF) | |
| Edétate disodique | |
| Monoglycérides distillées (Myverol 18-92) | |
| Triglycérides à chaîne moyenne (huile de coco fractionnée) | |
| Propylène glycol | |
| Hydroxyde de sodium | |
| Eau purifiée |
Informations complémentaires
Suspension pour pour-on de couleur rose.
Clinique
Indications d'utilisation par espèce
- Ovins
Prévention des myiases à Lucilia sericata chez les moutons.
Prévention des myiases à Wohlfahrtia magnifica chez les moutons.
Voie d'administration et posologie
Voie d'administration
- Cutanée
Posologie
- Ovins
Pour usage externe exclusivement.
Le médicament vétérinaire s’administre selon le schéma posologique suivant :
Poids vif (kg)
Volume à administrer (mL)
10-20
20
21-30
25
31-50
30
>50
35
(Les volumes indiqués correspondent à une dose de 0,6 – 2 mL de suspension (soit 30 – 100 mg de dicyclanil) par kg de poids vif).
Bien agiter le flacon avant utilisation.
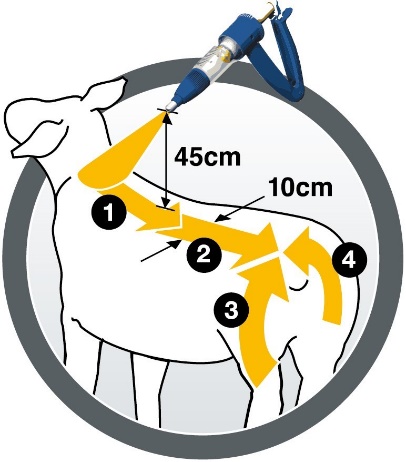
Le médicament vétérinaire doit être appliqué au pistolet, manuel ou automatique (le pistolet Elanco par exemple), équipé d'une buse de pulvérisation, qui garantit une bonne répartition du produit sur la toison. Les meilleurs résultats sont obtenus en tenant le pistolet à environ 45 cm du mouton pendant l’application. Pulvériser le médicament en utilisant une méthode d’application en quatre étapes, comme indiqué sur le pictogramme, le long de la ligne du dos de l'animal sur une bande d'au moins 10 cm de large du garrot à la croupe (la moitié de la dose) et une bande décrivant un arc de cercle autour de l'arrière-train et de la queue (reste de la dose).
Le médicament vétérinaire doit être administré une seule fois, avant la période d'infestation prévue par Wohlfahrtia, et, avant ou au début de la période d'infestation par Lucilia. Une application correcte permet une protection pendant 16 semaines contre les myiases à Wohlfahrtia ou à Lucilia. Dans certains cas, un épisode de myiase peut survenir précocement ; il est donc recommandé de surveiller régulièrement les animaux.
Ne pas tondre les moutons dans les trois mois qui suivent le traitement.
Temps d'attente
- Ovins
Denrée Durée Unité Voie(s) d'administration Viande et abats40 Jour
Complément d'information temps d'attente
Ne pas utiliser chez les brebis dont le lait est destiné à la consommation humaine.
Contre indications
Ne pas traiter les brebis dont le lait est destiné à la consommation humaine.
Ne pas utiliser en cas d’hypersensibilité connue au principe actif ou à l’un des excipients.
Mises en garde particulières à chaque espèce cible
Une utilisation non raisonnée d'antiparasitaires ou s'écartant des recommandations du RCP peut augmenter la pression de sélection de résistance et entraîner une diminution de l'efficacité. La décision d'utiliser le produit doit être fondée sur l’identification de l'espèce parasitaire et l’évaluation de la charge parasitaire, ou du risque d’infestation sur la base de ses caractéristiques épidémiologiques, pour chaque troupeau.
Précautions particulières d'emploi
Précautions particulières pour une utilisation sûre chez les espèces cibles
Idéalement, le médicament vétérinaire doit être administré avant l’apparition d’un épisode de myiase ou lorsqu’une attaque est identifiée dans l’élevage ou à proximité. Des épisodes avérés de myiase peuvent nécessiter un traitement séparé avec un insecticide à effet rapide.
Il est recommandé de nettoyer la région périnéale des animaux avant application. Si un nettoyage ou une tonte de la région périnéale a lieu dans les semaines qui suivent l’application, ces animaux devront être retraités pour éviter une perte de protection.
Ne pas traiter pendant de fortes pluies ou lorsque de telles conditions sont attendues prochainement car il pourrait en résulter une diminution de la durée de protection.
Précautions particulières à prendre par la personne qui administre le médicament
Les personnes appliquant le médicament vétérinaire doivent porter des gants en caoutchouc synthétique, un masque et un pantalon en PVC.
En cas de contact avec la peau, retirer les vêtements contaminés et nettoyer soigneusement les parties du corps concernées avec de l'eau et du savon.
En cas de contact avec les yeux, rincer abondamment à l'eau pendant plusieurs minutes et consulter un médecin. En cas d'ingestion accidentelle, demandez immédiatement conseil à un médecin et montrez-lui la notice ou l’étiquette.
Se laver les mains à l'eau et au savon après chaque manipulation des animaux et avant de manger, de boire ou de fumer.
Se laver les mains et les parties du corps exposées après avoir manipulé les animaux récemment traités. Ne pas manger, boire ou fumer pendant l'utilisation du médicament vétérinaire.
Manipulation des animaux dans les semaines qui suivent le traitement :
Ne pas tondre les moutons dans les 3 mois qui suivent le traitement.
Manipuler le moins possible les moutons après traitement car le produit demeure sur la toison pendant plusieurs semaines.
Si vous avez besoin de manipuler les animaux après traitement, porter une combinaison et des bottes. Si les moutons sont mouillés, porter des vêtements imperméables.
Précautions particulières concernant la protection de l'environnement
Ce médicament vétérinaire a des effets nocifs sur les mouches coprophiles.
Les moutons doivent être tenus éloignés des cours d'eau pendant au moins une heure après traitement. Si cette recommandation n'est pas suivie, il y a un risque grave pour les poissons et autres organismes aquatiques.
Autres précautions
Aucune.
Interactions médicamenteuses et autres formes d'interaction
Aucune connue.
Utilisation en cas de gravidité de lactation ou de ponte
Gestation et lactation :
L'innocuité de la spécialité n'a pas été étudiée pendant la gestation ou la lactation.
L'utilisation du produit doit se faire après évaluation du rapport bénéfice/risque par le vétérinaire.
Les études en laboratoires chez les rats et les lapins n'ont pas mis en évidence d'effets tératogènes, fœtotoxiques, maternotoxiques.
Effets indésirables
Espèce cible : Ovins
Aucun connu.
Il est important de notifier les effets indésirables. La notification permet un suivi continu de l’innocuité d’un médicament vétérinaire. Les notifications doivent être envoyées, de préférence par l’intermédiaire d’un vétérinaire, soit au titulaire de l’autorisation de mise sur le marché ou à son représentant local, soit à l’autorité nationale compétente par l’intermédiaire du système national de notification. Voir la notice pour les coordonnées respectives.
Surdosage (symptômes, conduite d’urgences, antidotes)
Un surdosage supérieur à 5 fois la dose recommandée n'entraîne aucun signe d'intolérance locale ou systémique. Aucun antidote n'est connu.
Antimicrobiens et antiparasitaires : lutte contre les résistances
Sans objet.
Informations pharmacologiques ou immunologiques
codes ATC
QP53AX24 : dicyclanile
Pharmacodynamie
Le mode d'action du dicyclanil n'est pas connu mais il serait similaire à celui de la cyromazine, un dérivé de la triazine. Analogue des benzoylphénylurées (BPU), il interfère avec la mue et la pupaison mais sans agir directement sur la synthèse de la chitine. Le dicyclanil bloque la mue du stade larvaire 1 au stade larvaire 2 de Lucilia spp. et Wohlfahrtia spp.
Pharmacocinétique et environnement
7 jours après traitement, environ 5 % de la dose appliquée a été absorbée et éliminée dans l'urine et les fèces. L'absorption systémique varie selon des facteurs tels que la densité et la longueur de la laine et la race de mouton. Le pic sanguin est atteint 12 à 48 heures après administration et représente moins de 0,025 mg d'équivalent dicyclanil/kg.
Des études expérimentales de déplétion de résidus marqués ont montré que la radioactivité absorbée est largement distribuée dans l'organisme. Les temps de demi-vie d'élimination les plus longs sont pour le foie et les reins, avec des valeurs respectives de 13 et 10 jours.
Le dicyclanil sous forme non métabolisée représente le principal résidu retrouvé dans le muscle, la graisse et la laine. Dans le foie et les reins, les résidus principalement retrouvés sont le descyclopropyl-dicyclanil ainsi que le dicyclanil sous forme non métabolisée.
Données pharmaceutiques
Incompatibilités majeures
Sans objet.
Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 5 ans.
Durée de conservation après ouverture
Durée de conservation après première ouverture du conditionnement primaire : 1 an.
Précautions particulières de conservation selon pertinence
À conserver à l'abri du gel.
À conserver dans l’emballage d'origine.
Conserver l'emballage soigneusement fermé.
Protéger des rayons directs du soleil.
Précautions particulières à prendre lors de l'élimination de médicaments non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Le médicament vétérinaire ne doit pas être déversé dans les cours d’eau car la substance active pourrait mettre les poissons et autres organismes aquatiques en danger.
Utiliser les dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné.
Nature et composition du conditionnement primaire
L’emballage est composé d’un bidon blanc opaque en polyéthylène avec un bouchon à vis bleu en polypropylène, contenant 0,8, 2,2 ou 5 litres de produit fini.
Titulaire de l'autorisation de mise sur le marché
ELANCO
Heinz-Lohmann-Strasse 4
27472 Cuxhaven
Allemagne
Présentations commercialisées et AMM
| Présentation | GTIN | Numéro d'autorisation de mise sur le marché | Date de première mise sur le marché (ou AMM) | Classement du médicament en matière de délivrance | Accessible aux groupements |
|---|---|---|---|---|---|
| Flacon de 2,2 litres | 05420036915249 | FR/V/5251046 3/2002 | 3/25/2002 | Soumis à prescription | Oui |
| Flacon de 5 litres | 05420036915317 | FR/V/5251046 3/2002 | 3/25/2002 | Soumis à prescription | Oui |
Responsable de la mise sur le marché
ELANCO FRANCE
Crisco Uno, Bâtiment C
3-5 avenue de la Cristallerie
92310 Sèvres - France
Responsable de la Pharmacovigilance
ELANCO FRANCE
Crisco Uno, Bâtiment C
3-5 avenue de la Cristallerie
92310 Sèvres - France
