Composition
Principes actifs et excipients
Principes actifs
| Nom du principe actif | Quantité de principe actif |
|---|---|
| Flubendazole | 44 mg/mL |
Excipients
| Nom de l'excipient | Quantité de l'excipient |
|---|---|
| Parahydroxybenzoate de méthyle (E 218) | 1.8 mg/mL |
| Parahydroxybenzoate de propyle (E 216) | 0.2 mg/mL |
| Glycérol | |
| Carbomères | |
| Hydroxyde de sodium | |
| Eau purifiée |
Informations complémentaires
Pâte orale inodore, de couleur blanche à crème.
Clinique
Indications d'utilisation par espèce
- Chien
- Chat
Affections à parasites sensibles au flubendazole :
Traitement des helminthoses digestives dues à :
Toxocara canis
Toxocara cati
Toxascaris leonina
Uncinaria stenocephala
Ankylostoma caninum
Ankylostoma tubaeforme
Trichuris vulpis
Taenia pisiformis
Hydatigera taeniaeformis
Taenia hydatigena.
Voie d'administration et posologie
Voie d'administration
- Orale
Posologie
- Chien
- Chat
22 mg de flubendazole par kg de poids corporel et par jour, soit 1 mL de pâte par 2 kg de poids corporel par jour.
Pendant 2 jours lors d'infestations par des ascaris ou des ankylostomes et pendant 3 jours consécutifs lors d'infestations par les autres types d'helminthes.Mode d’administration :
Tenir l’applicateur d'une main au niveau du piston et avec l'autre main ajuster la bague de dosage en la tournant en fonction du poids corporel de l'animal de sorte que le bord supérieur de la bague (2) corresponde au repère du poids (kg) de l’animal (1).
Retirez le capuchon (3) et appuyez sur le piston de l'applicateur jusqu'à ce qu'il s'arrête.
Pour chaque traitement ultérieur, ajoutez le poids corporel de l'animal et ajustez le dosage ; par exemple pour un chat de 5 kg devant être traité pendant 3 jours consécutifs, le bord supérieur de la bague de dosage (2) est réglé à 5 kg pour le premier jour de traitement, 10 kg pour le deuxième jour de traitement et 15 kg pour le troisième jour de traitement.
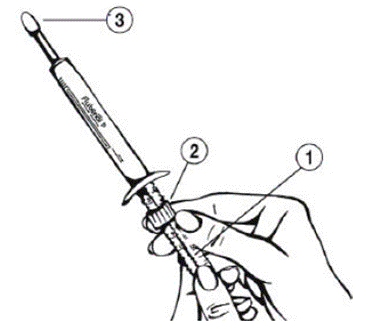
La dose recommandée est introduite directement dans la gueule du chien ou du chat ou bien mélangée à la nourriture (cette méthode est recommandée avec les animaux agressifs ou difficiles à immobiliser).
Temps d'attente
Complément d'information temps d'attente
Sans objet.
Contre indications
Aucune connue.
Mises en garde particulières à chaque espèce cible
Aucune.
Précautions particulières d'emploi
Précautions particulières pour une utilisation sûre chez les espèces cibles
Aucune.
Précautions particulières à prendre par la personne qui administre le médicament
Se laver les mains après usage.
Précautions particulières concernant la protection de l'environnement
Sans objet.
Autres précautions
-
Interactions médicamenteuses et autres formes d'interaction
Aucune connue.
Utilisation en cas de gravidité de lactation ou de ponte
L’innocuité du médicament vétérinaire chez les femelles en gestation ou allaitantes a été établie.
Gestation et lactation :
Peut être utilisé au cours de la gestation et de la lactation.
Les études de laboratoire sur les rats et les lapins n’ont pas mis en évidence d’effets tératogènes ou embryotoxiques du flubendazole à la dose utilisée en thérapeutique.
Effets indésirables
Chiens et chats.
Très rare (<1 animal / 10 000 animaux traités, y compris les cas isolés): | Diarrhée1, vomissements2 |
1 Modérée
2 Transitoires
Il est important de notifier les effets indésirables. La notification permet un suivi continu de l’innocuité d’un médicament vétérinaire. Les notifications doivent être envoyées, de préférence par l’intermédiaire d’un vétérinaire, soit au titulaire de l’autorisation de mise sur le marché soit à l’autorité nationale compétente par l’intermédiaire du système national de notification. Voir la notice pour les coordonnées respectives.
Surdosage (symptômes, conduite d’urgences, antidotes)
Aucun effet indésirable n'a été observé après l'administration du médicament vétérinaire à des doses 5 fois supérieures à celle recommandée.
Informations pharmacologiques ou immunologiques
codes ATC
QP52AC12 : flubendazole
Pharmacodynamie
Le flubendazole est un anthelminthique à large spectre appartenant à la famille des benzimidazoles ; il est actif sur les ascaridés, les ankylostomes, les trichocéphales et certains taenias isolés chez les chiens et les chats.
Le flubendazole a une action rapide et sélective sur les parasites gastro-intestinaux. Il interagit avec le système microtubulaire des cellules responsables de l'absorption des nutriments. Ceci conduit à la mort et l'expulsion des parasites.
Pharmacocinétique et environnement
Le flubendazole est faiblement hydrosoluble. Ceci se traduit par une faible biodisponibilité du principe actif par voie orale, et une excrétion fécale élevée de la molécule parentale.
Après administration orale chez le chien, le flubendazole est éliminé dans les fèces (plus de 80 %) sous forme parentale et dans les urines (moins de 10 %) sous forme de métabolites.
Données pharmaceutiques
Incompatibilités majeures
Aucune connue.
Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 30 mois.
Température de conservation
À conserver à une température ne dépassant pas 25°C.
Précautions particulières à prendre lors de l'élimination de médicaments non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Utiliser les dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné.
Nature et composition du conditionnement primaire
Applicateur polyéthylène
Bouchon polyéthylène
Piston polyéthylène
Bague de réglage polyéthylène
Titulaire de l'autorisation de mise sur le marché
ELANCO
Heinz-Lohmann-Strasse 4
27472 Cuxhaven
Allemagne
Présentations commercialisées et AMM
| Présentation | GTIN | Numéro d'autorisation de mise sur le marché | Date de première mise sur le marché (ou AMM) | Classement du médicament en matière de délivrance | Accessible aux groupements |
|---|---|---|---|---|---|
| Boîte de 1 applicateur gradué de 7,5 mL de pâte | 05420036921882 | FR/V/1709197 6/1991 | 8/1/1991 | Non soumis à prescription | Non |
Responsable de la mise sur le marché
ELANCO FRANCE
Crisco Uno, Bâtiment C
3-5 avenue de la Cristallerie
92310 Sèvres - France
Responsable de la Pharmacovigilance
ELANCO FRANCE
Crisco Uno, Bâtiment C
3-5 avenue de la Cristallerie
92310 Sèvres - France
Compléments d'informations
Date de mise à jour du RCP
4/16/2025Gamme thérapeutique
Gamme thérapeutique
Antiparasitaire internePathogènes (genre)
- Toxocara
- Trichuris
- Ancylostoma
- Uncinaria
- Toxascaris
- Taenia
