
NAXCEL® 200 mg/mL Suspension injectable pour bovins
ZOETIS FranceSuspension injectable
Composition
Principes actifs et excipients
Principes actifs
| Nom du principe actif | Quantité de principe actif |
|---|---|
| Ceftiofur (sous forme d’acide libre cristallin) | 200 mg |
Excipients
| Nom de l'excipient |
|---|
| Triglycérides à chaîne moyenne |
| Huile de coton |
Informations complémentaires
Suspension opaque de couleur blanche à marron clair.
Clinique
Indications d'utilisation par espèce
- Bovins
Chez les bovins, traitement curatif de la nécrobacillose interdigitée aiguë également appelée panaritium ou panaris interdigité.
Chez les bovins, traitement de la métrite aigüe post-partum (puerpérale) dans les cas où le traitement avec un autre antibiotique a échoué.
Voie d'administration et posologie
Voie d'administration
- Sous-cutanée
Posologie
- Bovins
6,6 mg ceftiofur /kg de poids vif (équivalent à 1 ml de médicament vétérinaire pour 30 kg de poids vif) en administration unique par voie sous-cutanée à la base de l’oreille.
Afin de garantir une posologie appropriée, le poids corporel doit être déterminé aussi précisément que possible.
Il est recommandé de limiter le volume injecté à 30 ml par site d’injection.
Agiter le flacon vigoureusement pendant 30 secondes ou jusqu’à ce que tout le dépôt visible soit à nouveau en suspension.
Administration à la base de l’oreille :
• Administrer dans la partie postérieure de la base de l’oreille (voir Figure 1).
• Tenir la seringue et insérer l’aiguille derrière l’oreille de l’animal de façon à ce que l’aiguille et la seringue pointent en direction d’une ligne fictive qui traverserait la tête vers l’œil opposé de l’animal (voir Figure 2).
• Prendre les précautions appropriées pour éviter une injection intra-artérielle ou intraveineuse, comme une contention appropriée de l'animal (couloir de contention par exemple) et l'utilisation d'aiguilles appropriées (2,54 cm de long, calibre 16 G).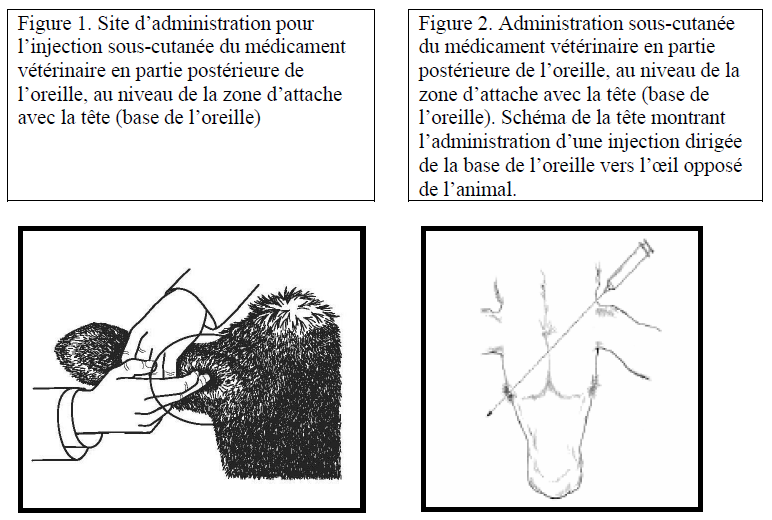
Si les signes cliniques ne s’améliorent pas 48 heures après le traitement, le diagnostic et le traitement doivent être réévalués.
Temps d'attente
Complément d'information temps d'attente
Viande et abats : 9 jours.
Lait : Zéro jour.
Il est fondamental que le médicament vétérinaire soit uniquement administré par voie sous-cutanée à la base de l’oreille dans un tissu non comestible, comme décrit au paragraphe 3.9, de façon à respecter le temps d’attente viande.
Contre indications
Ne pas utiliser en cas d’hypersensibilité à la substance active, à d’autres bêta-lactamines ou à l’un des excipients.
Mises en garde particulières à chaque espèce cible
Aucune.
Précautions particulières d'emploi
Précautions particulières pour une utilisation sûre chez les espèces cibles
Les céphalosporines à large spectre administrées par voie systémique (3ème et 4ème générations, dont le ceftiofur) doivent être réservées au traitement de situations cliniques qui ont répondu faiblement ou sont susceptibles de répondre faiblement à des antimicrobiens non critiques. Une utilisation accrue, notamment l’utilisation en dehors des recommandations du Résumé des Caractéristiques du Produit (RCP), est susceptible d’augmenter la prévalence des bactéries résistantes au ceftiofur. Les directives officielles nationales et régionales sur l’utilisation des antimicrobiens doivent être prises en compte lors de l’utilisation du produit.
Dans la mesure du possible, le médicament vétérinaire ne devrait être utilisées qu’après avoir réalisé un test de sensibilité. Il est recommandé de prendre en compte la gestion globale du troupeau et d’utiliser des traitements de soutien avec des produits locaux adaptés (par ex. désinfectants) lors de la mise en place du traitement.
Ne pas utiliser en prophylaxie de routine des rétentions placentaires.
Précautions particulières à prendre par la personne qui administre le médicament
Les pénicillines et les céphalosporines, comme le ceftiofur peuvent provoquer une hypersensibilité chez les humains et les animaux à la suite de leur injection, inhalation, ingestion ou au contact de la peau. L’hypersensibilité aux pénicillines peut conduire à des réactions croisées avec les céphalosporines et réciproquement. Les réactions allergiques à ces substances peuvent occasionnellement être graves.
En cas d'hypersensibilité connue aux pénicillines et céphalosporines, éviter tout contact avec le médicament vétérinaire.
Eviter le contact avec les yeux et la peau. En cas de contact rincer immédiatement à l’eau claire.
Si, à la suite d’une exposition, vous développez des symptômes comme un érythème cutané, ou une irritation persistante des yeux, consultez un médecin et montrez-lui la notice ou l’étiquette. Un œdème du visage, des lèvres, des yeux ou une difficulté respiratoire sont des symptômes plus sévères et nécessitent une consultation médicale d’urgence.
Précautions particulières concernant la protection de l'environnement
N/A
Autres précautions
N/A
Interactions médicamenteuses et autres formes d'interaction
Aucune connue.
Utilisation en cas de gravidité de lactation ou de ponte
Les études de laboratoire sur la souris n’ont pas mis en évidence d’effets tératogènes, foetotoxiques ou maternotoxiques. Les études de laboratoires chez le rat ne révèlent pas d’effets tératogènes mais des effets maternotoxiques (fèces molles) et foetotoxiques (diminution du poids fœtal) ont été observés. Aucun effet sur les performances reproductrices n’a été observé. Aucune étude n’a été menée chez les vaches gestantes et les reproducteurs. L’utilisation ne doit se faire qu’après évaluation bénéfice/risque établie par le vétérinaire responsable.
Ce médicament vétérinaire peut être utilisé pendant la lactation.
Effets indésirables
Bovins:
Très fréquent (>1 animal / 10 animaux traités): | Gonflement au site d’injection1, Douleur au site d’injection2 |
Très rare (<1 animal / 10 000 animaux traités, y compris les cas isolés): | Anaphylaxie, Mort subite3 |
¹Visible deux jours après l'injection chez environ deux tiers des animaux traités et disparaissant dans un délai maximum de 23 jours.
²Légère à modérée dans les premiers jours suivant l'injection.
³Suite à une administration intra-vasculaire accidentelle ou à une anaphylaxie.
Il est important de notifier les effets indésirables. La notification permet un suivi continu de l’innocuité d’un médicament vétérinaire. Les notifications doivent être envoyées, de préférence par l’intermédiaire d’un vétérinaire, soit au titulaire de l’autorisation de mise sur le marché ou à son représentant local, soit à l’autorité nationale compétente par l’intermédiaire du système national de notification. Voir également la notice pour les coordonnées respectives.
Surdosage (symptômes, conduite d’urgences, antidotes)
Chez les bovins, bien que le médicament vétérinaire n’ait pas été spécifiquement testé avec des surdosages, aucun signe de toxicité systémique liée au ceftiofur n’a été observé après des administrations parentérales quotidiennes de 55 mg/kg pendant cinq jours.
Informations pharmacologiques ou immunologiques
codes ATC
QJ01DD90 : ceftiofur
Pharmacodynamie
Le ceftiofur est une céphalosporine de troisième génération qui est active contre de nombreux germes pathogènes Gram-positif et Gram-négatif. Le ceftiofur inhibe la synthèse de la paroi de la cellule bactérienne, ce qui est à l’origine de ses propriétés bactéricides.
Chez les bovins, le ceftiofur est actif sur les micro-organismes suivants présents dans les métrites aigües post–partum (puerpérales) : Escherichia coli, Arcanobacterium pyogenes et Fusobacterium necrophorum et dans le panaris interdigité chez les bovins : Bacteroides spp., Fusobacterium necrophorum, Porphyromonas spp. and Prevotella spp.
Le desfuroylceftiofur est le principal métabolite actif. Il possède une activité antimicrobienne identique à celle du ceftiofur contre les germes pathogènes cibles.
Pharmacocinétique et environnement
Le ceftiofur est bien absorbé chez les bovins après une injection à la base de l’oreille. Après administration, le ceftiofur est rapidement métabolisé en desfuroylceftiofur, principal métabolite actif. Le taux de liaison aux protéines du ceftiofur et de son principal métabolite est élevé, environ 70% - 90%. Une heure après une administration unique, les concentrations plasmatiques sont supérieures à 1 μg/ml. Les concentrations plasmatiques maximales (environ 5 μg/ml) sont atteintes à partir de 12 heures après l’administration. Des concentrations plasmatiques totales supérieures à 0,2 μg/ml et 1,0 μg/ml pour le ceftiofur et ses métabolites actifs sont maintenus respectivement pendant au moins 7 et 4 jours.
Données pharmaceutiques
Incompatibilités majeures
En l’absence d’études de compatibilité, ce médicament vétérinaire ne doit pas être mélangé avec d’autres médicaments vétérinaires.
Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 2 ans.
Durée de conservation après ouverture
Durée de conservation après première ouverture du flacon : 28 jours.
Température de conservation
À conserver à une température ne dépassant pas 25°C.
Précautions particulières à prendre lors de l'élimination de médicaments non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Utiliser les dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné.
Nature et composition du conditionnement primaire
Boîte en carton contenant un flacon en verre type I de 100 ml muni d’un bouchon en chlorobutyl-isoprène et d’une capsule aluminium.
Titulaire de l'autorisation de mise sur le marché
Zoetis Belgium
Rue Laid Burniat 1
1348 Louvain-la-Neuve
BELGIQUE
Présentations commercialisées et AMM
| Présentation | GTIN | Numéro d'autorisation de mise sur le marché | Date de première mise sur le marché (ou AMM) | Classement du médicament en matière de délivrance | Accessible aux groupements |
|---|---|---|---|---|---|
| Boîte de 1 flacon de 100 mL | 05414736017457 | EU/2/05/053/003 | 5/19/2005 | Soumis à prescription | Non |
Responsable de la mise sur le marché
ZOETIS France
107 AVENUE DE LA REPUBLIQUE
92320 CHATILLON
Zoetis Assistance 0800 73 00 65
Responsable de la Pharmacovigilance
ZOETIS France
107 AVENUE DE LA REPUBLIQUE
92320 CHATILLON
Zoetis Assistance 0800 73 00 65
Compléments d'informations
Date de mise à jour du RCP
7/3/2023Gamme thérapeutique
Gamme thérapeutique
AntibiotiquePathogènes (genre)
- Arcanobacterium
- Fusobacterium
- Porphyromonas
- Escherichia
