PREVICOXⓇ 227 mg comprimés à croquer pour chiens
BOEHRINGER INGELHEIM ANIMAL HEALTH FRANCE SCSComprimé à croquer
Composition
Principes actifs et excipients
Principes actifs
| Nom du principe actif | Quantité de principe actif |
|---|---|
| Firocoxib | 227 mg |
Excipients
| Nom de l'excipient |
|---|
| Lactose monohydraté |
| Cellulose microcristalline |
| Arôme fumée |
| Hydroxypropylcellulose |
| Croscarmellose sodique |
| Stéarate de magnésium |
| Caramel (E 150d) |
| Silice colloïdale anhydre |
| Oxyde de fer jaune (E 172) |
| Oxyde de fer rouge (E 172) |
Informations complémentaires
Chaque comprimé à croquer contient :
Substance active :
Firocoxib …………………………………………………………………… 227 mg
Apparence :
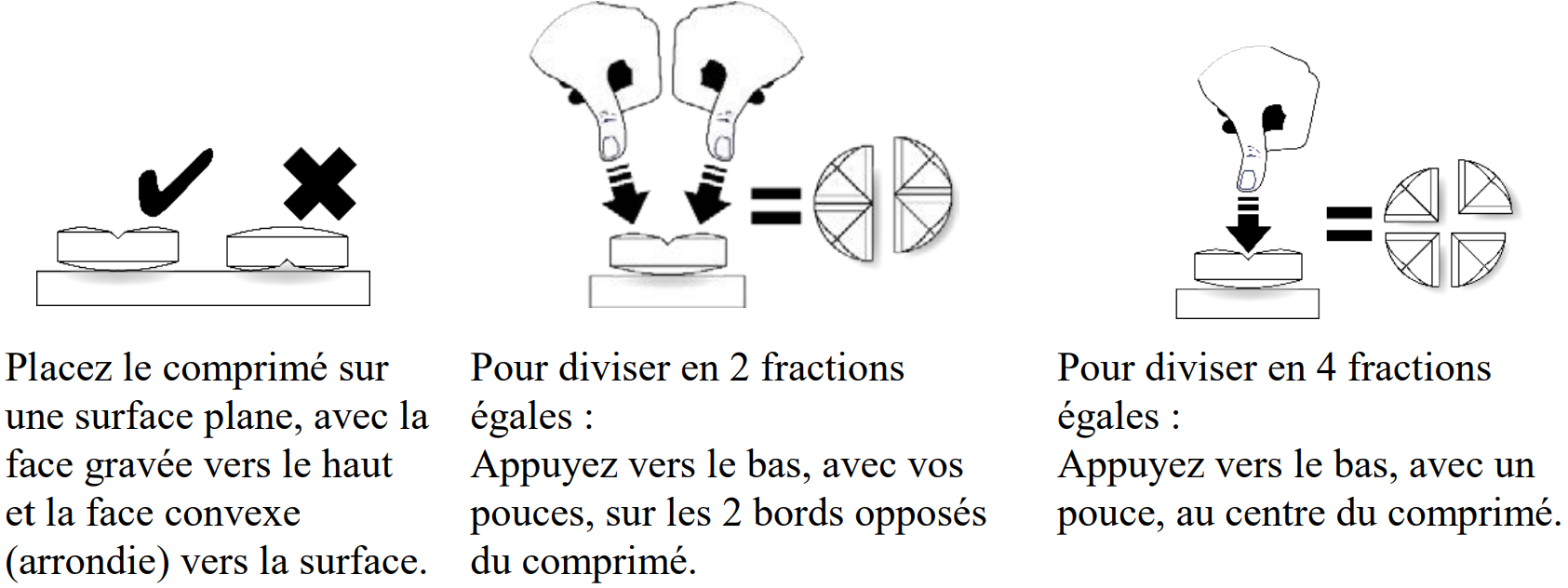
Comprimés à croquer brun clair ronds convexes avec une barre de cassure cruciforme sur une face. Les comprimés à croquer peuvent être divisés en 2 ou 4 fractions égales.
Clinique
Indications d'utilisation par espèce
- Chien
Soulagement de la douleur et de l’inflammation associées à l’arthrose chez le chien.
Soulagement de la douleur post-opératoire et de l’inflammation associée à la chirurgie des tissus mous, à la chirurgie orthopédique et à la chirurgie dentaire chez le chien.
Voie d'administration et posologie
Voie d'administration
- Orale
Posologie
- Chien
Voie orale.
Arthrose :
Administrer 5 mg/kg de poids vif en une fois par jour selon le tableau ci-dessous.
Les comprimés peuvent être mélangés ou non à l’alimentation.
La durée du traitement varie selon la réponse observée. Comme la durée des études de terrain était limitée à 90 jours, la mise en place d’un traitement plus long devrait être évaluée avec attention et faire l’objet d’un suivi vétérinaire régulier.
Soulagement de la douleur post-opératoire :
Administrer une dose quotidienne de 5 mg/kg de poids vif selon le tableau ci-dessous, jusqu’à 3 jours si nécessaire. La première dose est administrée environ 2 heures avant l’opération.
Après une chirurgie orthopédique et en fonction de la réponse observée, le traitement peut être poursuivi après les 3 premiers jours, en suivant la même posologie quotidienne et laissé à l’appréciation du vétérinaire traitant.
Poids corporel (kg)
Nombre de comprimés à croquer
par présentation
mg/kg
57 mg
227 mg
3,0 – 5,5
0,5
-
5,2 – 9,5
5,6 – 7,5
0,75
-
5,7 – 7,6
7,6 – 10
1
0,25
5,7 – 7,5
10,1 - 13
1,25
-
5,5 – 7,1
13,1 – 16
1,5
-
5,3 – 6,5
16,1 – 18,5
1,75
-
5,4 – 6,2
16,1 – 18,5
-
0,5
5,0 – 6,1
22,6 – 34
-
0,75
5,0 – 7,5
34,1 – 45
-
1
5,0 – 6,7
45,1 – 56
-
1,25
5,1 - 6,3
56,1 – 68
-
1,5
5,0 - 6,1
68,1 – 79
-
1,75
5,0 - 5,8
79,1 – 90
-
2
5,0 - 5,7
Les comprimés peuvent être divisés en 2 à 4 fractions égales pour permettre un ajustement précis de la dose.
Temps d'attente
Complément d'information temps d'attente
Sans objet.
Contre indications
Ne pas utiliser chez les chiennes gestantes ou en lactation.
Ne pas utiliser chez les animaux âgés de moins de 10 semaines ou pesant moins de 3 kg.
Ne pas utiliser chez des animaux présentant un saignement gastro-intestinal, un trouble de la coagulation sanguine ou des troubles hémorragiques.
Ne pas utiliser en association avec des corticostéroïdes ou d’autres anti-inflammatoires non stéroïdiens (AINS).
Mises en garde particulières à chaque espèce cible
Aucune.
Précautions particulières d'emploi
Précautions particulières pour une utilisation sûre chez les espèces cibles
Ne pas dépasser la dose recommandée, voir rubrique « Posologie et voie d'administration ».
L’utilisation chez de très jeunes animaux, ou chez des animaux atteints d’insuffisance rénale, cardiaque ou hépatique (suspectée ou confirmée), peut entraîner des risques supplémentaires. Si une telle utilisation ne peut être évitée, celle-ci devra être effectuée sous surveillance vétérinaire stricte.
Éviter d’utiliser chez des animaux déshydratés, en hypovolémie ou en hypotension, en raison du risque accru de toxicité rénale. Toute association avec des produits ayant un potentiel néphrotoxique doit être évitée.
En cas de risque de saignement gastro-intestinal ou en cas d’intolérance connue aux AINS, le produit doit être utilisé sous surveillance vétérinaire stricte. Des troubles rénaux et/ou hépatiques ont été rapportés dans de très rares occasions chez des chiens ayant reçu le traitement à la dose recommandée. Il est possible qu’une proportion de tels cas soit due à une pathologie hépatique ou rénale subclinique antérieure au début du traitement. Par conséquent, des examens de laboratoire appropriés pour établir les paramètres biochimiques rénaux ou hépatiques de base sont recommandés avant et périodiquement pendant l'administration.
Le traitement doit être interrompu en présence d’un des signes suivants : diarrhées à répétition, vomissements, sang occulte dans les selles, perte de poids soudaine, anorexie, léthargie, dégradation des paramètres biochimiques hépatiques ou rénaux.
Précautions particulières à prendre par la personne qui administre le médicament
Se laver les mains après utilisation du produit.
En cas d’ingestion accidentelle, demandez immédiatement conseil à un médecin et montrez-lui la notice ou l’étiquette.
Remettre les fractions de comprimés dans l’emballage d’origine.
Précautions particulières concernant la protection de l'environnement
Sans objet.
Autres précautions
Sans objet.
Interactions médicamenteuses et autres formes d'interaction
Un traitement préalable par d’autres anti-inflammatoires peut entraîner l’apparition ou l’aggravation d’effets indésirables. Il est donc recommandé d’observer une période de 24 heures sans traitement avant de commencer le traitement avec le médicament vétérinaire. La durée de cette période de transition doit cependant être adaptée en fonction des propriétés pharmacocinétiques des produits utilisés précédemment.
Ne pas administrer le médicament vétérinaire simultanément avec d’autres AINS ou des glucocorticoïdes. Des ulcères gastro-intestinaux peuvent être exacerbés par les corticostéroïdes chez les animaux recevant des anti-inflammatoires non-stéroïdiens.
Un traitement simultané avec des molécules ayant un effet sur le flux sanguin rénal, telles que les diurétiques ou les inhibiteurs de l’enzyme de conversion de l’angiotensine (IECA), doit faire l’objet d’un suivi clinique. Toute association avec des produits ayant un potentiel néphrotoxique doit être évitée en raison d’un risque accru de toxicité rénale. Les produits anesthésiques pouvant affecter la perfusion rénale, une fluidothérapie parentérale doit être envisagée pendant l’opération afin de réduire de potentielles complications rénales lors de l’utilisation d’AINS en péri-opératoire.
L’utilisation simultanée d’autres principes actifs fortement liés aux protéines peut entraîner une compétition avec le firocoxib sur les sites de liaison, et avoir par conséquent des effets toxiques.
Utilisation en cas de gravidité de lactation ou de ponte
Gestation et lactation :
Ne pas utiliser chez les chiennes gestantes ou en lactation.
Les études de laboratoire sur les lapins ont mis en évidence des effets maternotoxiques et fœtotoxiques, à des doses proches de celles recommandées pour le chien.
Effets indésirables
Chiens :
Peu fréquent (1 à 10 animaux / 1 000 animaux traités) : | Vomissements1 et diarrhées1 |
Rare (1 à 10 animaux / 10 000 animaux traités) : | Symptômes nerveux |
Très rare (< 1 animal / 10 000 animaux traités, y compris les cas isolés) : | Troubles hépatiques et troubles rénaux |
(1) : Généralement passagères et réversibles à l'arrêt du traitement.
Si des effets secondaires apparaissent tels que vomissements, diarrhées à répétition, sang occulte dans les selles, perte de poids soudaine, anorexie, léthargie, dégradation des paramètres biochimiques hépatiques ou rénaux, le traitement doit être interrompu et un vétérinaire doit être consulté. Comme lors de l’utilisation d’autre AINS, des effets secondaires très graves peuvent avoir lieu et, dans des cas très rares, peuvent engager le pronostic vital.
Il est important de notifier les effets indésirables. La notification permet un suivi continu de l’innocuité d’un médicament vétérinaire. Les notifications doivent être envoyées, de préférence par l’intermédiaire d’un vétérinaire, soit au titulaire de l’autorisation de mise sur le marché ou à son représentant local, soit à l’autorité nationale compétente par l’intermédiaire du système national de notification. Voir la notice pour les coordonnées respectives.
Surdosage (symptômes, conduite d’urgences, antidotes)
Chez des chiens âgés de 10 semaines en début de traitement à des doses égales ou supérieures à 25 mg/kg/jour (5 fois la dose recommandée) pendant 3 mois les signes suivants de toxicité ont été observés : perte de poids, perte d’appétit, remaniements du foie (accumulation de lipides), du cerveau (vacuolisation), du duodénum (ulcères) et mortalité. À des doses supérieures à 15 mg/kg/jour (3 fois la dose recommandée) administrées pendant 6 mois, des réactions similaires ont été observées, mais la fréquence et la gravité étaient inférieures et il n’y avait pas d’ulcères duodénaux. Au cours de ces études de tolérance chez l’animal cible, les effets indésirables étaient réversibles chez certains chiens à l’arrêt du traitement.
Chez des chiens âgés de 7 mois en début de traitement à des doses égales ou supérieures à 25 mg/kg/jour (5 fois la dose recommandée) pendant 6 mois, des effets indésirables gastro-intestinaux (vomissements) étaient observés.
Aucune étude de surdosage n’a été effectuée chez des animaux âgés de plus de 14 mois.
Si des symptômes de surdosage sont observés, interrompez le traitement.
Antimicrobiens et antiparasitaires : lutte contre les résistances
Sans objet.
Informations pharmacologiques ou immunologiques
codes ATC
QM01AH90 : firocoxib
Pharmacodynamie
Le firocoxib est un anti-inflammatoire non stéroïdien (AINS) de la famille des Coxibs, agissant par inhibition sélective de la synthèse des prostaglandines médiée par la cyclooxygénase-2 (COX-2). La cyclo-oxygénase est responsable de la formation des prostaglandines. Il a été montré que la COX-2 est l’isoforme de l’enzyme induite par des stimuli pro-inflammatoires et serait le principal responsable de la synthèse des médiateurs prostanoïdes de la douleur, de l’inflammation et de la fièvre. Les Coxibs ont par conséquent des propriétés analgésiques, anti-inflammatoires et antipyrétiques. On estime que la COX-2 est également impliquée dans l’ovulation, l’implantation, la fermeture du canal artériel, et dans les fonctions du système nerveux central (induction de la fièvre, perception de la douleur et fonction cognitive). Dans des essais in vitro sur sang total de chien, le firocoxib montre une sélectivité envers la COX-2 environ 380 fois plus importante qu’envers la COX‑1. La concentration de firocoxib nécessaire à inhiber 50 % de l’activité de l’enzyme COX-2 (CI50) est de 0,16 (± 0,05) µM, alors que la CI50 de la COX-1 est de 56 (± 7) µM.
Pharmacocinétique et environnement
Après administration orale chez le chien à la dose préconisée de 5 mg par kg de poids vif, le firocoxib est rapidement absorbé et la concentration maximale est atteinte en 1,25 (± 0,85) heure (Tmax). Le pic de concentration (Cmax) est de 0,52 (± 0,22) µg/mL (équivalent à environ 1,5 µM), l’aire sous la courbe (AUC 0-24) est de 4,63 (± 1,91) µg h/mL, et la biodisponibilité orale est de 36,9 % (± 20,4). La demi-vie d’élimination (t½) est de 7,59 (± 1,53) heures. La liaison du firocoxib aux protéines plasmatiques est d’environ 96 %. Après administration orale de doses multiples, l’état d’équilibre est atteint à la 3ème dose journalière.
Le firocoxib est principalement métabolisé par désalkylation et glucurono-conjugaison dans le foie. L’élimination se fait essentiellement par la bile et le tractus gastro-intestinal.
Données pharmaceutiques
Incompatibilités majeures
Sans objet.
Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 4 ans.
Durée de conservation après ouverture
Les fractions de comprimés peuvent être conservées jusqu’à 1 mois dans l’emballage d’origine.
Température de conservation
À conserver à une température ne dépassant pas 30 °C.
Précautions particulières de conservation selon pertinence
À conserver dans l'emballage d'origine.
Précautions particulières à prendre lors de l'élimination de médicaments non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Ne pas jeter les médicaments dans les égouts ou dans les ordures ménagères.
Utiliser les dispositifs de reprise mis en place pour l’élimination de tout médicament vétérinaire non utilisé ou des déchets qui en dérivent, conformément aux exigences locales et à tout système national de collecte applicable au médicament vétérinaire concerné.
Nature et composition du conditionnement primaire
Les comprimés à croquer Previcox sont fournis dans des plaquettes (PVC transparent/feuille d’aluminium) ou dans des flacons en polyéthylène haute densité de 30 mL ou 100 mL (avec un bouchon en polypropylène).
Les comprimés à croquer (57 mg ou 227 mg) sont disponibles dans les conditionnements suivants :
- 1 boîte en carton contenant 1 plaquette de 10 comprimés (10 comprimés)
- 1 boîte en carton contenant 3 plaquettes de 10 comprimés (30 comprimés)
- 1 boîte en carton contenant 18 plaquettes de 10 comprimés (180 comprimés)
- 1 boîte en carton contenant 1 flacon de 60 comprimés
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l'autorisation de mise sur le marché
Boehringer Ingelheim Vetmedica GmbH
BINGER STRASSE 173
55216 INGELHEIM AM RHEIN
ALLEMAGNE
Présentations commercialisées et AMM
| Présentation | GTIN | Numéro d'autorisation de mise sur le marché | Date de première mise sur le marché (ou AMM) | Classement du médicament en matière de délivrance | Accessible aux groupements |
|---|---|---|---|---|---|
| PREVICOXⓇ227 mg comprimés à croquer pour chiens Boîte en carton contenant 3 plaquettes de 10 comprimés (30 comprimés) | 04028691562948 | EU/2/04/045/004 | 9/13/2004 | Soumis à prescription | Non |
| PREVICOXⓇ 227 mg comprimés à croquer pour chiens Boîte en carton contenant 1 flacon de 60 comprimés | 04028691563396 | EU/2/04/045/009 | 9/13/2004 | Soumis à prescription | Non |
| PREVICOXⓇ 227 mg comprimés à croquer pour chiens Boîte en carton contenant 18 plaquettes de 10 comprimés (180 comprimés) | 04028691562979 | EU/2/04/045/006 | 9/13/2004 | Soumis à prescription | Non |
Responsable de la mise sur le marché
BOEHRINGER INGELHEIM ANIMAL HEALTH FRANCE SCS
29 avenue Tony Garnier
69007 LYON
FRANCE
Responsable de la Pharmacovigilance
BOEHRINGER INGELHEIM ANIMAL HEALTH FRANCE SCS
29 avenue Tony Garnier
69007 LYON
FRANCE



